心房細動アブレーションを振り返る
皆さんこんにちは。この度reviewの機会を頂きました川上大志です。Kawakami’s reviewは自分の専門である不整脈シリーズにしたいと思っています。今回は近年日本でも盛んに行われるようになった心房細動(AF)アブレーションに関する話題提供です。AFアブレーションの変遷を振り返りつつ、最新のトピックスに触れたいと思います。
1. 肺静脈隔離のはじまり
AFアブレーションの基本は皆さんご存じの肺静脈隔離(pulmonary vein isolation: PVI)です。1998年にフランスのBordeaux大学の天才、Haïssaguerre先生らのグループが、AFのはじまりの興奮(トリガー)の大多数(90%以上)が肺静脈起源であることを報告しました(図1)¹。この論文を基にして肺静脈に対するアブレーションが始まりました。当初のAFアブレーションはこのトリガーの起源をピンポイントで焼灼しようというものでした(focal ablation)。当然成功率は低く、通電部位がPVの奥になってしまうため、肺静脈狭窄という重篤な合併症が多く生じていたようです(死亡例も!)。その後、起源そのものへのアブレーションではなく、その下流を焼灼してPV全体を電気的に隔離する方法が提唱されました²。このコンセプトが今日に至る拡大PVIに発展していったのです。現在では、高周波を用いたアブレーションにもたくさんの焼き方が報告されています(図2)³。また、テクノロジーの進歩により、高周波だけでなくクライオアブレーションやホットバルーン、レーザーアブレーション等が使用できるようになりました(本邦未承認を含む)。それぞれに長所短所がありますが、どの方法を用いたとしても「確実にPVIを完成させること」が最重要であることに変わりありません。肺静脈の再伝導はアブレーション後のAF再発の最大の原因となりますので、初回のアブレーションで如何にきっちりPVIを行えるかが腕の見せ所でもあります。
図1:今日のPVIを創ったといって過言ではない伝説のfigure! (文献1)

図2:様々なPVI。日循ガイドライン(文献3)より。Box isolationによるPVIは後述。
2. Beyond PVI
PVIの確立により、AFアブレーションの成績は格段に向上しました。しかしながら、どんなにテクノロジーや技術が発達しても、再発を来す患者さんが存在します。そこで、少しでも再発率を減らすべく様々なプラスアルファのアブレーションが考案されました。この追加アブレーションには、大きく分けて「トリガーに対するアブレーション」と「基質に対するアブレーション」が存在します。
2.1. トリガーに対する追加アブレーション
非肺静脈起源心房細動トリガー(non-PV foci)に対するアブレーション
上記の通り、AFトリガーの大多数はPV起源ですが、PV以外を起源とする、いわゆるnon-PV fociを合併している患者さんが少なからず存在することが報告されています⁴。中でも上大静脈起源が最も有名です。Non-PV fociを合併している症例では、PVIに加えてnon-PV fociに対するアブレーション(SVC隔離やトリガーに対するfocal ablation)を行うことで成績向上が期待されます⁵。心房の変性が進行していない発作性AFに対しては、PVI+non-PV fociアブレーションが一般的なアブレーション戦略になると思います(図3) (もちろん施設毎に様々な方針が存在しますが)。

図3:発作性AFにおける検討(文献5)。Group1:Non-PV fociが誘発されず。Group2:Non-PV fociが誘発され、かつ、治療成功。Group3 :Non-PV fociが誘発されたが治療不成功。結果はご覧の通り。Non-PV fociの治療が成功すれば合併なしと同等の成績が報告されています(log-rank: groups 1 vs. 2; P = .8942, groups 1 vs. 3; P < .0001, group 2 and 3; P < .0001.)。
2.2 基質に対する追加アブレーション
左房のリモデリングが進行してしまった持続性AFでは、上記の二つだけでは良好な成績が期待できないことが多いです。ゆえに、これまで様々なAF基質に対する追加アブレーションが検討されてきました。いわゆるsubstrate modificationです。代表的なものを簡単にご紹介します。
2.2.1. 心房内線状焼灼 (Linear ablation)
2000年代前半から提唱され始めた方法です。PVIに加えて、心房内に線状焼灼を加えます。外科的に行われるMaze手術がベースになっています。左房天蓋部へのブロックラインや左房前壁ライン、僧帽弁輪狭部に対するブロックライン、左房天蓋部のラインに後壁下部のラインを追加した後壁隔離などの方法があり、PVIに追加することでアブレーション成績が向上することが報告されました6-8。高度なカテーテル操作が不可欠ですが、3Dマッピング技術やカテーテルの進歩でラインの完成度は昔より格段に高まっています。

図4:左房線状焼灼(左)および左房後壁隔離(Box isolation) (右)。文献3より引用。
2.2.2. CFAE (complex fractionated atrial electrogram)アブレーション
AF中の心房で確認されるCFAEと呼ばれる異常電位を細かくマッピングして根こそぎ焼き尽くすという方法です。Brugada症候群に対するアブレーション治療(後日reviewします)で知られるNademanee先生が2003年に提唱された方法です⁹。問題点はCFAEの見分け方が難しいこと、焼灼回数がどうしても多くなってしまうことです。

図5:CFAEアブレーション(文献3より引用)
2.2.3. Rotorアブレーション/ FIRM (focal impulse and rotor modulation)アブレーション
AF が持続する機序の1つにMother Rotor説というものがあります。興奮周期が非常に短い小さなリエントリー(rotor)が心房に存在し、そのrotorがAFを持続させているという仮説です。このrotorを焼灼してしまえばAFが持続しないだろうという理論で考案されたのがrotorアブレーション(FIRMアブレーション)です10,11。心房内に多極電極を配置し、特殊な解析装置を用いてrotorを特定し焼灼します。

図6:FIRMアブレーション(文献10より)。
他にも心臓周囲の自律神経節(GP)に対するアブレーション12や心房低電位領域を標的にしたアブレーション方法13などたくさんの方法が提唱されています。しかしながら、これら追加アブレーションはAFアブレーションの成績向上が期待できる反面、手技や焼灼時間が長くなり、合併症や医原性心房頻拍(焼灼により新たに生じた不整脈基質が原因となって生じる心房頻拍)が増加するという問題を抱えています。最小限の侵襲で最大の効果が期待できるアブレーション方法の選択が不可欠です。いったいどの方法が良いのでしょうか?これまでに様々なトライアルが行われました。その中で、我々アブレーターに大きな影響を与えた、もしくは与えうる2つの論文をご紹介させて頂きます。
(1) Approaches to Catheter Ablation for Persistent Atrial Fibrillation
N Engl J Med. 2015 May 7;372(19):1812-22.
P (population): 持続性AF患者 589例
I (intervention): PVIにCFAEアブレーション追加(263例)もしくはPVIに線状焼灼追加(259例)
C (control): PVI単独(67例)
O (outcome): PVIにCFAEアブレーションもしくは線状焼灼を追加しても、持続性AFの再発を減らすことはできなかった。
ひとつ目はSTAR-AF Ⅱ Trialです。その後のアブレーション方針に非常に大きな影響を与えました。この試験結果はアブレーターにとってある意味ショッキングなものでした。良かれと思って頑張って行ってきた追加アブレーションの効果が否定されてしまったのです。しかも、合併症のテーブルを見ますと(表)、左房食道瘻に伴う死亡例がCFAE追加例で生じています!アブレーションに関連する数ある合併症の中で最も致死的なものが左房食道瘻です。これは左房後面に接している食道が焼灼の熱によって障害されて生じる合併症です。頻度は非常に希ですが、一度生じると致死的です。1例でも生じてほしくない重大合併症がNEJMに掲載されるような大規模試験に参加する施設で生じている事実は重く受け止めなければならないでしょう。もちろんこの試験の結果だけで全てのCFAEアブレーションや線状焼灼の意義が否定された訳ではありませんが、追加アブレーションにはリスクが伴うことを術者はしっかり胸に刻んでおかねばなりません。
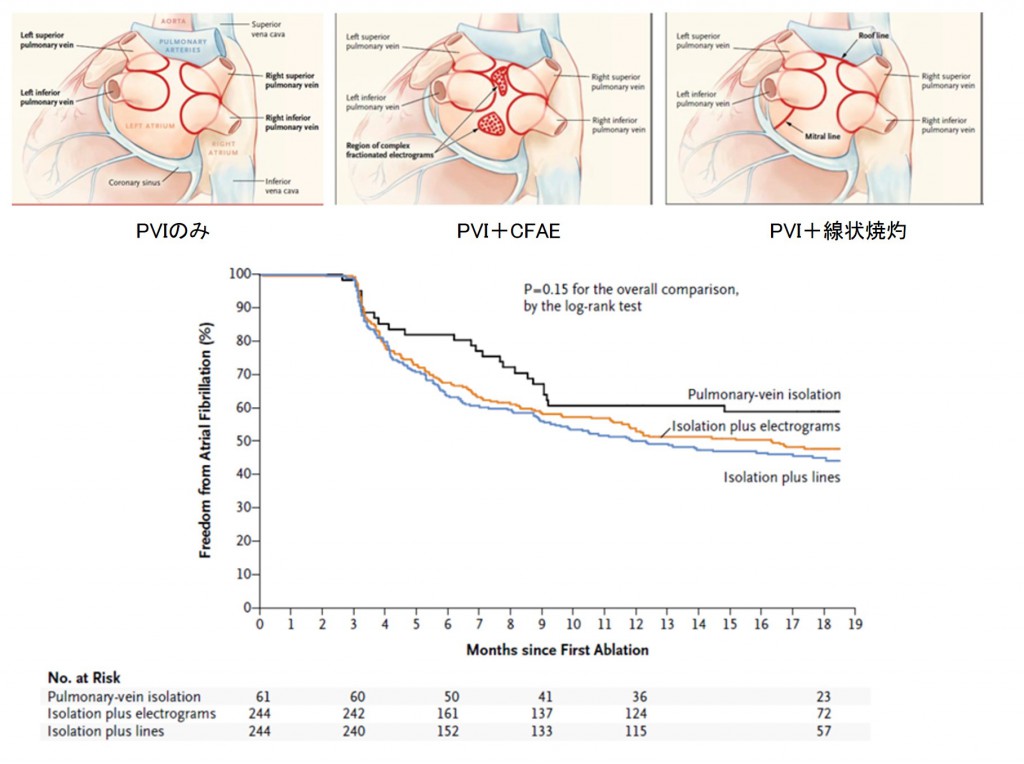
図7:アブレーション方法(上段)および成績(下段)
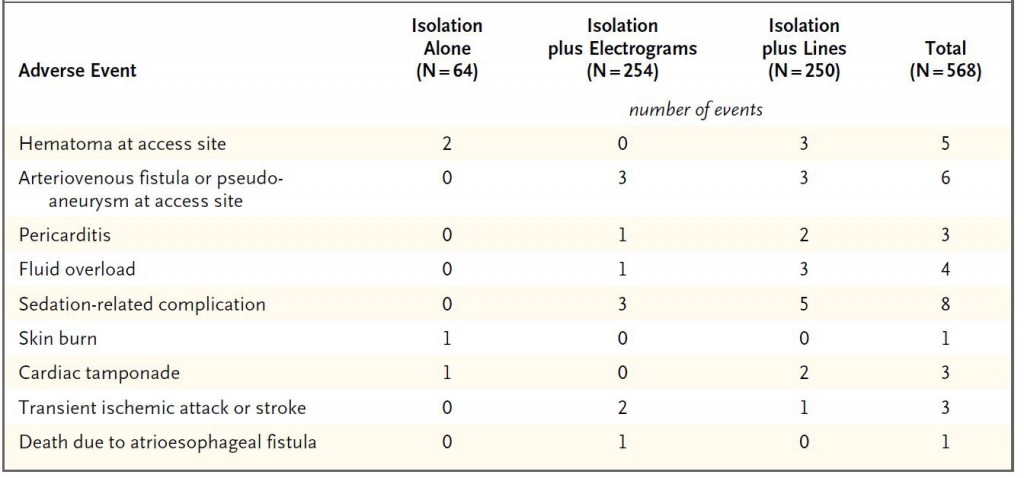
表:手技に伴う合併症。
(2) Long-Term Outcome of Pulmonary Vein Isolation With and Without Focal Impulse and Rotor Modulation Mapping: Insights From a Meta-Analysis.
Circ Arrhythm Electrophysiol. 2018 Mar;11(3):e005789.
P (population): 15論文から集められたAF患者511例(うち24%が発作性AF)
I (intervention): PVI単独+FIRMアブレーション(5論文)
C (control): PVI単独(10論文)
O (outcome): FIRMアブレーションはPVI単独に比べて、AF再発率を改善しなかった。FIRMアブレーションに関する再評価が不可欠である。
二つ目はFIRMアブレーションの効果を検討したメタ解析です。当初はFIRMアブレーションの前向きトライアルを紹介しようと思ったのですが、2016年にJACCに掲載された論文が撤回されたようですのでこちらにしました(試験デザインに不備があったようです)。上記のSTAR-AF Ⅱ試験と同様に、rotorアブレーションでも否定的な結果が報告されています。ちなみに、撤回されたJACCの論文もFIRMアブレーションに否定的な結果でした。

図8:メタ解析の結果。PVIにFIRMアブレーションを追加するメリットは示されなかった。
AFアブレーションの歴史を振り返ってきましたが、現在確実に言えることは、「PVIを確実に行う」ということに尽きると思います。ただし、誤解の無いよう繰り返しますが、決して追加アブレーションに意味が無いという訳ではありません。追加アブレーションによって初めてAFから解放された患者さん達がたくさんいらっしゃることは事実です。しかしながら、「追加アブレーションが有効な症例も確かに存在するが、ルーチンで行うべきではない」というのが現状だと思います。
参考文献
1. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. Haïssaguerre M, Jaïs P, Shah DC, Takahashi A, Hocini M, Quiniou G, Garrigue S, Le Mouroux A, Le Métayer P, Clémenty J. N Engl J Med. 1998;339:659-66.
2. Electrophysiological breakthroughs from the left atrium to the pulmonary veins. Haïssaguerre M, Shah DC, Jaïs P, Hocini M, Yamane T, Deisenhofer I, Chauvin M, Garrigue S, Clémenty J. Circulation. 2000 Nov 14;102(20):2463-5.
3. 循環器病の治療と診断に関するガイドライン(2010-2011年度合同研究班報告):カテーテルアブレーションの適応と手技に関するガイドライン.
4. Catheter ablation of paroxysmal atrial fibrillation initiated by non-pulmonary vein ectopy. Lin WS, Tai CT, Hsieh MH, Tsai CF, Lin YK, Tsao HM, Huang JL, Yu WC, Yang SP, Ding YA, Chang MS, Chen SA. Circulation. 2003 Jul 1;107(25):3176-83.
5. Importance of nonpulmonary vein foci in catheter ablation for paroxysmal atrial fibrillation. Hayashi K, An Y, Nagashima M, Hiroshima K, Ohe M, Makihara Y, Yamashita K, Yamazato S, Fukunaga M, Sonoda K, Ando K, Goya M. Heart Rhythm. 2015 Sep;12(9):1918-24
6. Technique and results of linear ablation at the mitral isthmus. Jaïs P, Hocini M, Hsu LF, Sanders P, Scavee C, Weerasooriya R, Macle L, Raybaud F, Garrigue S, Shah DC, Le Metayer P, Clémenty J, Haïssaguerre M. Circulation 2004; 110: 2996-3002
7. Techniques, evaluation, and consequences of linear block at the left atrial roof in paroxysmal atrial fibrillation: a prospective randomized study. Hocini M, Jaïs P, Sanders P, Takahashi Y, Rotter M, Rostock T, Hsu LF, Sacher F, Reuter S, Clémenty J, Haïssaguerre M. Circulation 2005: 112: 3688-3696.
8. A new approach for complete isolation of the posterior left atrium including pulmonary veins for atrial fibrillation. Kumagai K, Muraoka S, Mitsutake C, Takashima H, Nakashima H. J Cardiovasc Electrophysiol 2007; 18: 1047-52.
9. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. Nademanee K, McKenzie J, Kosar E, Schwab M, Sunsaneewitayakul B, Vasavakul T, Khunnawat C, Ngarmukos T. J Am Coll Cardiol 2004; 43: 2044-5.
10. Focal impulse and rotor modulation ablation of sustaining rotors abruptly terminates persistent atrial fibrillation to sinus rhythm with elimination on follow-up: a video case study. Narayan SM, Patel J, Mulpuru S, Krummen DE. Heart Rhythm. 2012 Sep;9(9):1436-9.
11. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). Narayan SM, Baykaner T, Clopton P, Schricker A, Lalani GG, Krummen DE, Shivkumar K, Miller JM. J Am Coll Cardiol. 2014; 63: 1761-8.
12. Pathophysiologic basis of autonomic ganglionated plexus ablation in patients with atrial fibrillation. Nakagawa H, Scherlag BJ, Patterson E, Ikeda A, Lockwood D, Jackman WM. Heart Rhythm. 2009 6:S26-34.
13. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. Yamaguchi T, Tsuchiya T, Nakahara S, Fukui A, Nagamoto Y, Murotani K, Eshima K, Takahashi N. J Cardiovasc Electrophysiol. 2016; 27:1055-63.
