医薬品開発を見据えた新たな薬剤ターゲットの探求
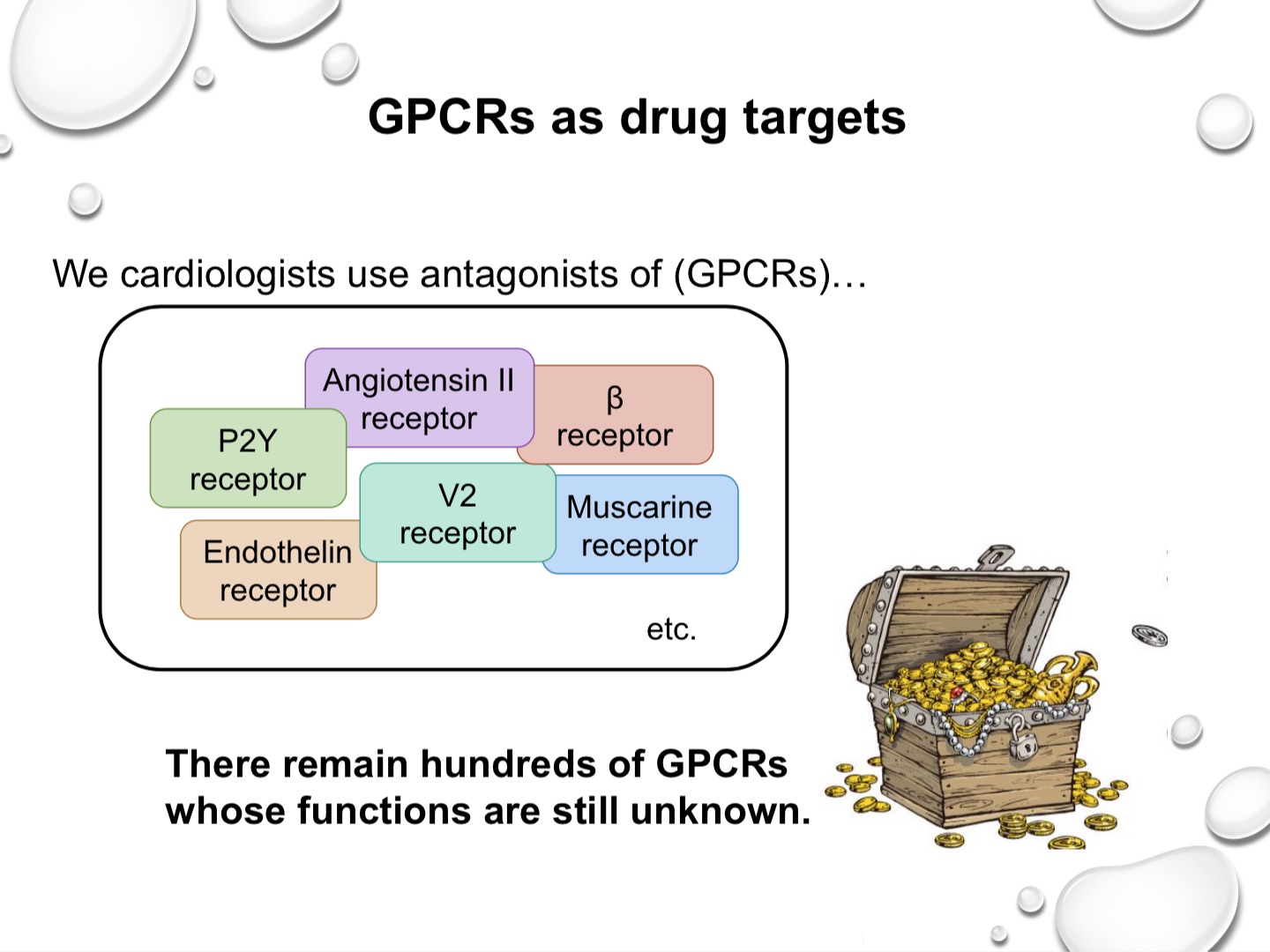
アンジオテンシンII受容体、β受容体、P2Y受容体、V2受容体、アセチルコリン受容体、エンドセリン受容体etc…
私たち循環器科医が日常的に処方している薬剤のターゲットであるこれらの受容体は、共通した構造上の特徴を持つ「Gタンパク質共役受容体(G protein-coupled receptor: GPCR)」に分類されます。GPCRに対する理解は医薬品の開発に大きく貢献したとして、京都大学の山中伸弥教授がノーベル生理学・医学賞を受賞したのと同じ2012年、ノーベル化学賞がこのGPCRの中心的研究を行ったDuke大学Robert J. Lefkowitz教授とStanford大学Brian K. Kobilka教授に贈られています。現在臨床で使用されている薬剤の約30%はGPCRを作用標的としていますが、その一方で、未だ150ものGPCRについてはその機能や結合する物質がわかっていません(図1)。
当PharmacologyラボのディレクターであるOffermanns教授は心血管領域におけるGPCRの専門家であり、マイルストーンとなる研究には、抗血小板作用に関わるP2Y受容体の下流シグナルの同定(Offermanns S, et al. Nature. 1997)や血管発生に関わるGPCRシグナル伝達の同定(Offermanns S, et al. Science. 1997)があります。当ラボは立ち上がってまだ12年ほどですが、現在多数のプロジェクトが同時進行しており、①心血管系における受容体シグナル伝達、②血管における機械的刺激センサー機構、③代謝系における受容体シグナル伝達、そして④がんの転移における血管の役割、をテーマとした各グループに分けられます。いずれも、臨床への橋渡し研究を法律・倫理・資金面からサポートする専門部門や国内外の創薬企業との連携のもと、最終的には新薬開発を目指しています。ここでは、私の属する①と、個人的に異文化とのハイブリッドが非常に興味深い④の業績をご紹介し、その中でのトレンドワードをピックアップしたいと思います。
<心血管系における受容体シグナル伝達>
このグループはこれまでに、血管内皮細胞(Sivaraj KK, et al. Dev Cell. 2013, Sivaraj KK et al. Cardiovasc Res. 2015)や心筋細胞(Takefuji M, et al. Circulation.2012, Takefuji M, et al. J Exp Med.2013)におけるGPCRシグナル伝達の新たな機能、また心臓線維芽細胞の活性化を制御する機構(Kaur H, et al. Circ Res. 2016)を同定してきました(図2)。最近ではシングルセル解析(後述〜Pick Up the Trend〜)を積極的に取り入れており、血管疾患において病的意義を有する細胞群にのみ特異的に発現するGPCRを同定し、新たな治療戦略に発展できることを発表しています(Kaur H, et al. Nat Commun. 2017)。
〜Pick Up the Trend〜 「シングルセル解析」
組織を構成する細胞は同じ種類であっても、1個1個性質が異なること(不均一性)が近年明らかにされています。シングルセル解析は細胞を1個1個、個別に解析していく方法であり、新しい研究手法として大きな注目を浴びています。この手法によって、細胞集団全体をひとまとめにして平均値で評価するこれまでの手法(バルク解析)では見逃されてきた新しい細胞種や細胞機能を解明できるようになっています(図3)。主に、その長所を最大限に発揮できるがん領域や幹細胞・発生領域での応用が先行していましたが、最近になって循環器領域でもシングルセル解析を用いた研究成果が出てきています(Skelly DA, et al. Cell Rep. 2018, Gladka MM, et al. Circulation. 2018)。今後は心筋症などの臨床検体に応用した報告も出てくるだろうと予想されます。
私は現在心臓におけるシングルセル解析のプロジェクトを担当していますが、解析によって得られる膨大な情報を処理するバイオインフォマティクスの重要性や、実験にかかるコストの高さを、身を持って体験しています。
<がんの転移における血管の役割>
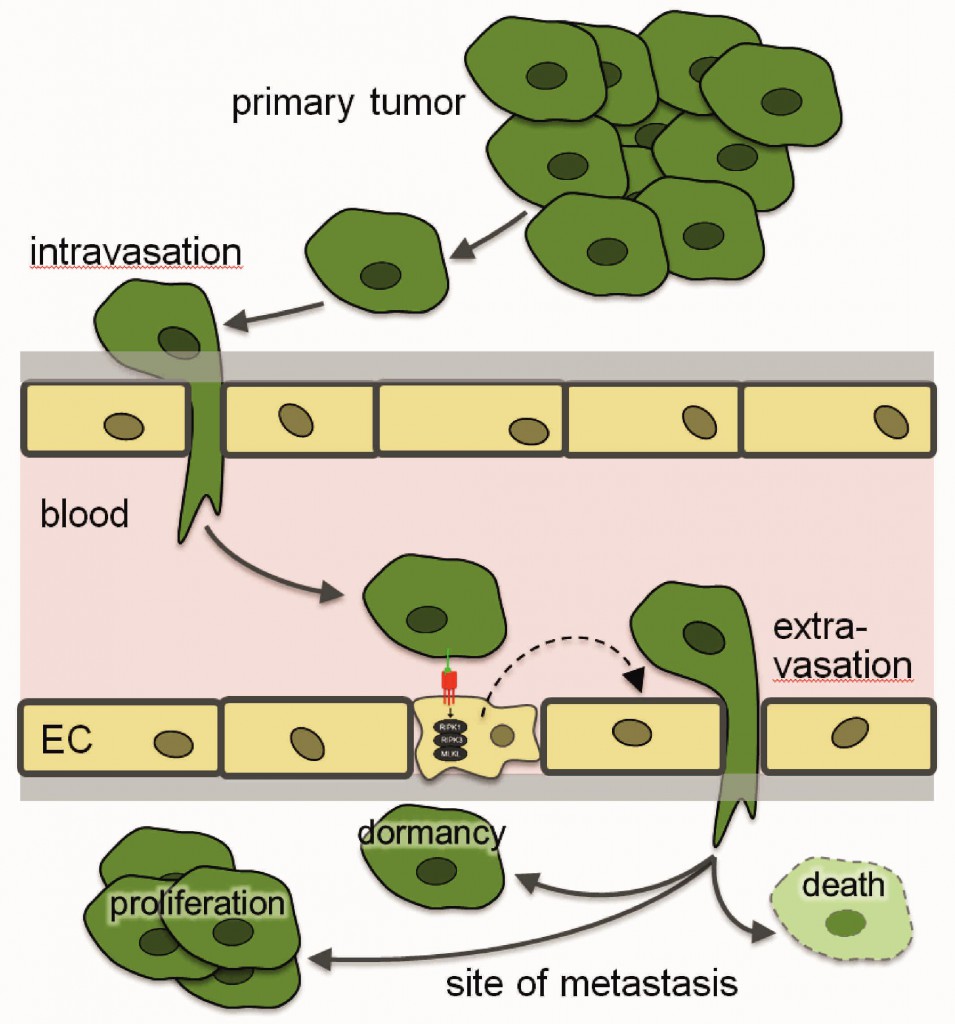
転移の過程はがん研究の最も重要な分野ですが、未だ解明されていない点が多く存在します。このグループでは、転移過程において血管内皮にスポットライトを当てた研究を行っています(図4)。転移は、がん細胞が血管内皮を突き破って血管内に入ることで始まります(intravasation)。そして、血液を流れるがん細胞が離れた組織に定着するためには、また血管内皮を破って組織へと遊出する必要があります(extravasation)。このように、血管内皮は“がん細胞の移動に対する障壁”として捉えることができる点(後述〜Pick Up the Trend〜)に注目したわけです。
このグループは、主に血管外遊出の場面において、血小板や血管内皮細胞ががん細胞との相互作用を示すことを報告しています(Schumacher D, et al. Cancer Cell. 2013, Strilic B and Offermanns S, Cancer Cell. 2017)。特に最近では、内皮細胞ががん細胞との接触で細胞死を起こし、その結果生じる隙間をがん細胞が通り抜けて転移が促進されることを明らかにし、このシグナル伝達に関わる内皮細胞の受容体(death receptor 6: DR6)が新たな治療標的となりうることを発表しています(図5; Strilic B, et al. Nature. 2016)。
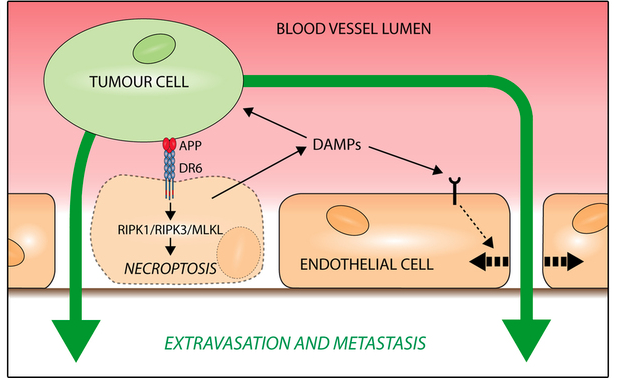
図5. がん細胞はdeath receptor 6 (DR6)を介して内皮細胞の細胞死(necroptosis)を起こし、その結果生じる隙間から血管外へ遊出する(Strilic B, et al. Nature. 2016)
〜Pick Up the Trend〜 「循環系とがん転移」
Onco-cardiology(腫瘍循環器学)という新たな臨床概念が提唱されたのとシンクロするように、血管・血流とがん転移を紐づけた研究が近年盛んに行われています。例えば、血管内のがん細胞が血液の流れによる物理的ストレスから身を守る方法(Furlow PW, et al. Nat Cell Biol. 2015)や、血管外へ遊出するために血管透過性を高める作用を発揮すること(Padua D, et al. Cell. 2008)が報告されています。臨床では、私たちが毎日処方するアスピリンのがん転移抑制効果を示したRCTも存在します(Rothwell PM, et al. Lancet. 2012)。
腫瘍と循環器という距離が遠いように見える分野を跨ぐことで、今後も新しい知見が得られることを期待します。