日本のラグ問題をアップデートする 〜デバイス編〜
後編はデバイスラグについてレビューします。
ドラッグラグとデバイスラグには共通する問題点も多くありますが、開発・承認審査の観点で医療機器が医薬品と最も異なる点は、そのバリエーションの豊富さです。私たち循環器科医が扱うものだけでも、冠動脈ステント、人工弁、植え込み型医療機器、カテーテル類、補助循環、など数え上げればキリがありませんが、使用手技や効果はもとより、フォローの仕方、さらには材料特性まで、製品の多様性は極めて大きいです。故に開発や承認審査についてもその考え方は一様ではありません。それを踏まえた上で、今回はデバイスラグについて総論的なトピックをまとめたいと思います。
<EU→米国→日本>
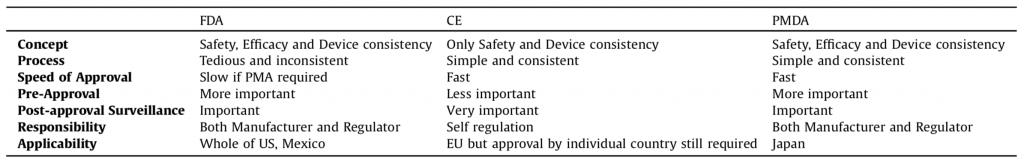
まず基本的な事項として、米国、EU、日本という大枠に分けて、医療機器の普及様式を概観します。医薬品と同様に、医療機器の承認審査は日本ではPMDA、米国ではFDAによって行われます。一方EUでは、品質・安全性に関する自己宣言を主体とする認証制度、CEマークによって医療機器が市場導入されます。CEマークに比べ、FDAやPMDAの承認審査では、より高水準な安全性・有効性に関するデータが求められます(表1, 文献1)。そのため、これまで多くの医療機器メーカーは、①小規模の臨床データでCEマークを取得してまずEUで流通させる、②次にFDA承認を得るために大規模臨床試験を行う、③FDA承認後にPMDAへの承認申請を検討する、という開発戦略を取ってきました(文献2)。ここからもわかるように、日本におけるデバイスラグは、PMDAへの承認申請に至るまでの時間差、すなわち「開発ラグ」に大きく依存しています。一方、PMDAの審査の遅れによる「審査ラグ」は、医薬品と同様に、昨今では劇的に短くなっています(表1, 文献1)。
<DES承認プロセスの変遷から見る米国との協調の有用性>
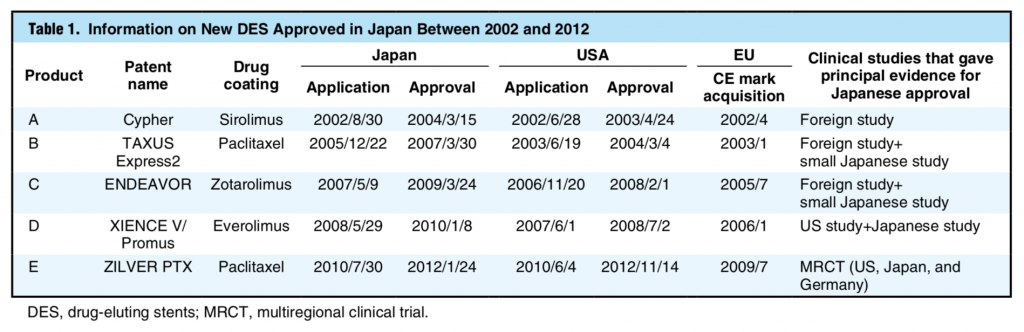
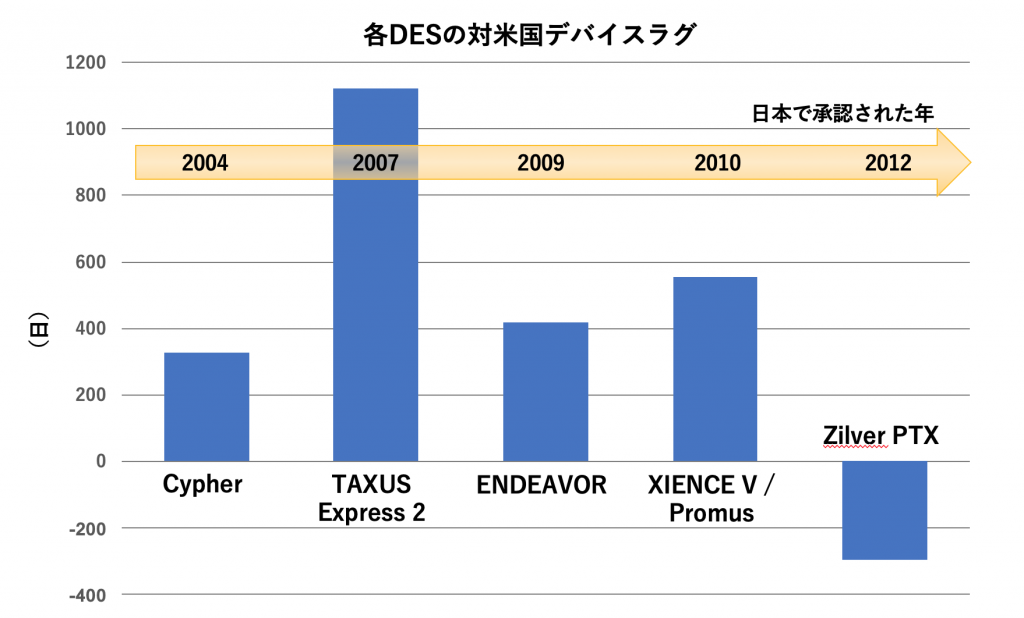
具体的な一例として、DESの承認プロセスに関する論文を紹介します(文献2)。この論文では、年代順に、Cypher、TAXUS Express2、ENDEAVOR、XIENCE V / Promus、Zilver PTXという5つのDESの国内承認プロセスについて、対米国ラグの観点から考察されています(表2, 図1)。なお、全てのDESにおいて、CEマーク取得はFDA承認よりも数年先行しています。
まず、鮮烈なデビューを果たした初代DESであるCypherは、その新規性とは裏腹に日本国内治験がなされずに優先的に承認されました(シロリムスの薬物動態に関する小規模試験は行われています)。そのため、ラグは比較的短くなっています。この背景には、既にアジア国を含む海外の臨床試験においてCypherがPCIのゲームチェンジャーになりうる結果が示されており、国内治験追加による安全性評価のメリットよりも、それに伴い承認が遅れることによる患者不利益が上回ると判断された経緯があります。
次のTAXUS Express2では、米国治験の約3年後に国内治験が行われたため、ラグが長くなっています。続くENDEAVORおよびXIENCE V / Promusでは、Harmonization By Doing (HBD)という日米の医療機器開発の同調を目指す新たな活動のもとに、日本では米国治験とほぼ同一のプロトコルで治験が行われました。このHBDが奏功し、この二者ではTAXUS Express2に比べラグが短縮しています。
そしてこの流れを汲んで、最後のZilver PTXでは、DESで初めて、日本を含む国際共同治験が行われました。さらに、この頃にはPMDAの審査時間は以前より短くなっており、結果的に開発国の米国よりも早く国内承認が達成されたのです。
このDESの一例からだけでも、デバイスラグを短縮させるにはどうすれば良いか、という問いに対する答えがいくつか読み取れると思います。
<早期承認の促進は市販後リスク管理の徹底と一体>
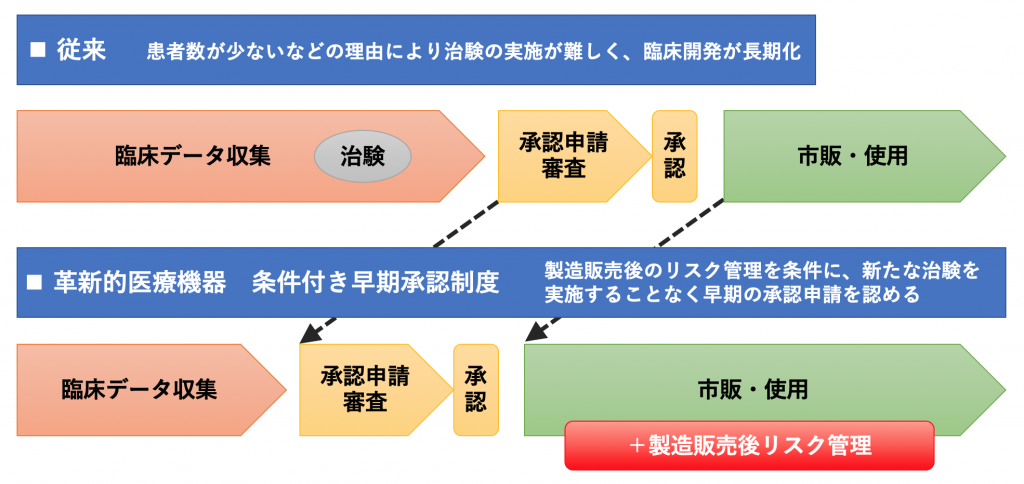
Cypherの例に見られるように、ニーズの高いデバイスを優先して早期導入する仕組みは以前から存在していましたが、その他にも最近では「革新的医療機器条件付き早期承認制度」という早期承認を促進する制度が2017年に厚生労働省によって策定されています(図2, 文献3)。これは、対象症例数が少なく治験の実施は困難だがニーズの高い新規医療機器に関して、市販後のリスク管理やデータ収集を条件に実用化を早める、というものです。この市販後の対応は、近年、医療機器審査全般においてもより重要視されております。例えば私たちにも馴染みのある、使用施設の限定やレジストリといったものもそれに該当しますが、これらの計画・実施には関連学会が大きな役割を持ちます。
<日本市場ではメーカーが高コストに見合うだけの回収を得られにくい>
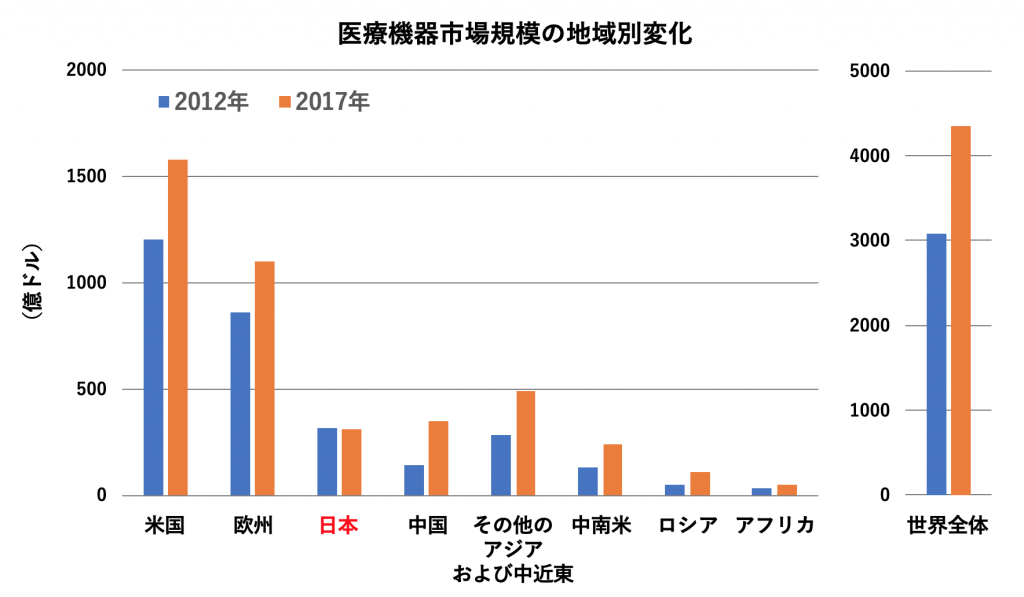
ドラッグラグと同様に、デバイスラグを産む大きな要因として、日本市場の魅力の低さが挙げられます。医療機器市場は世界で全体的に拡大している一方、日本の市場成長は停滞しています(図3, 文献4)。
少し説明を加えます。メーカーが日本で治験を行い承認を得るには少なくとも数億円かかり、この費用はEU諸国の数十倍とも言われています(文献5)。また、集約化された医療機関にメーカーがまとまった量の機器を直送する欧米と異なり、日本では、より多くの医療機関に薄く広く機器を供給する必要があるため、主に卸事業者を経由した流通様式になっています。当然ここにも多額のコストがかかります。しかしながら一方で、日本での保険償還価格はこのコスト構造の違いを加味した設定にはなっておらず、結果的に日本市場はメーカーから敬遠されることになるのです。実際、米国で承認された医療機器のうち、約3分の1は日本で申請すらされておらず(=デバイスギャップ)、メーカーが日本で承認申請をしない理由の半分以上は経済的な理由であることが報告されています(文献5)。
<デバイスラグにまつわるその他の事項>
上に挙げた薬事制度のこと、国際共同治験を含む国際協調の有用性、市場としての側面の他にも、デバイスラグと言えば、様々な事項が想起されます。
小暮先生もレポートで切実に訴えられているように、循環器領域の中でも一つ一つのデバイスの対象症例が少ない先天心分野では特に、デバイスラグ、さらにはデバイスギャップが発生しやすく、深刻な問題となっています(文献6)。治療法が制限されることに加え、リスクを負いながらも適応外デバイスを使用せざるを得ない場合のストレスは計り知れません。
ラグの状況を改善するために私たち医師自身が出来ることとして、医師主導治験の実施や先進医療の申請が挙げられます。ここでは詳細に述べる余裕がありませんが、前者では研究費用、また後者では患者負担などの問題点が含まれています。
また、医療機器の国内開発を促進することも、デバイスラグを打開する一手になり得ます。ベンチャーの開発力そのものの推進、それに対する投資活動の活性化など、現状多くの難題があります。
<引用文献>
1. Mishra S, et al. Indian Heart J. 2017;69:1-5.
2. Murakami M, et al. Circ J. 2018;82:636-643.
3. 厚生労働省. 医療機器の迅速かつ的確な承認及び開発のための治験ガイダンス. 2017年.
4. Espicom Business Inteligence. Medistat worldwide medical market forecasts to 2017.
5. 米国医療機器・IVD工業会. 医療機器提供コストの日欧比較調査. 2009年.
6. Nakagawa N, et al. Journal of JPIC. 2016;1:2-12.
<あとがき>
2編に渡って、ドラッグラグおよびデバイスラグについてレビューしました。循環器領域では、日常診療の中でこのラグ問題を実感することがしばしばあります。患者と対峙する私たち医師が、「ラグは不利益だ、ラグは解消すべきだ」と考えることはとても自然ですが、もう一歩踏み込んで、「ラグにはどんな要因があってそれらがどれだけ解決困難なものか」、「ラグ解消に向けて誰がどのような取り組みを行っているか」、ということを知ると、このラグ問題がいかに壮大なものかがわかります。これは留学後に、PMDAの方とお話する機会の中で、審査ラグ短縮の裏にはスタッフの途轍もない労力があることを伺ったり、当ラボと医薬品企業の合同会議に立ち会って新薬開発を目指す産学の一体感を肌で感じたりした経験を通じて、私自身が痛感したことでもあります。
厚生労働省やPMDA、企業、アカデミア、そして医療を提供する私たち。ラグ問題には、これらの普段は全く違う仕事をしている人々が関わります。ラグ解消には各々の協力関係や働きかけが不可欠、と単に言うだけでは中身の薄い一般論になってしまいますが、少し見方を変えて、例えば医療の専門家である私たちが、PMDAに入って薬事承認に従事する、レギュラトリーサイエンスの研究を行う、あるいは開発側に回る、など多様なキャリアへもっと広がることもラグ解消への一助になるのでは、と空想してみたりしています。