IL-1βモノクローナル抗体の華々しい臨床試験結果に投じられた一石
今回は、IL-1βモノクローナル抗体(IL-1β Ab)に関する基礎研究論文を取り上げます。
Interleukin-1β has atheroprotective effects in advanced atherosclerotic lesions of mice.
Gomez D, et al. Nat Med. 2018 Sep; 24(9): 1418-1429.
この記事を書いている時点では、パブリッシュされたばかりの超最新論文ですが、基礎と臨床のデータを包括して議論する意義を存分に感じられる一枚になっており、その点にウエイトを置いて紹介したいと思います。
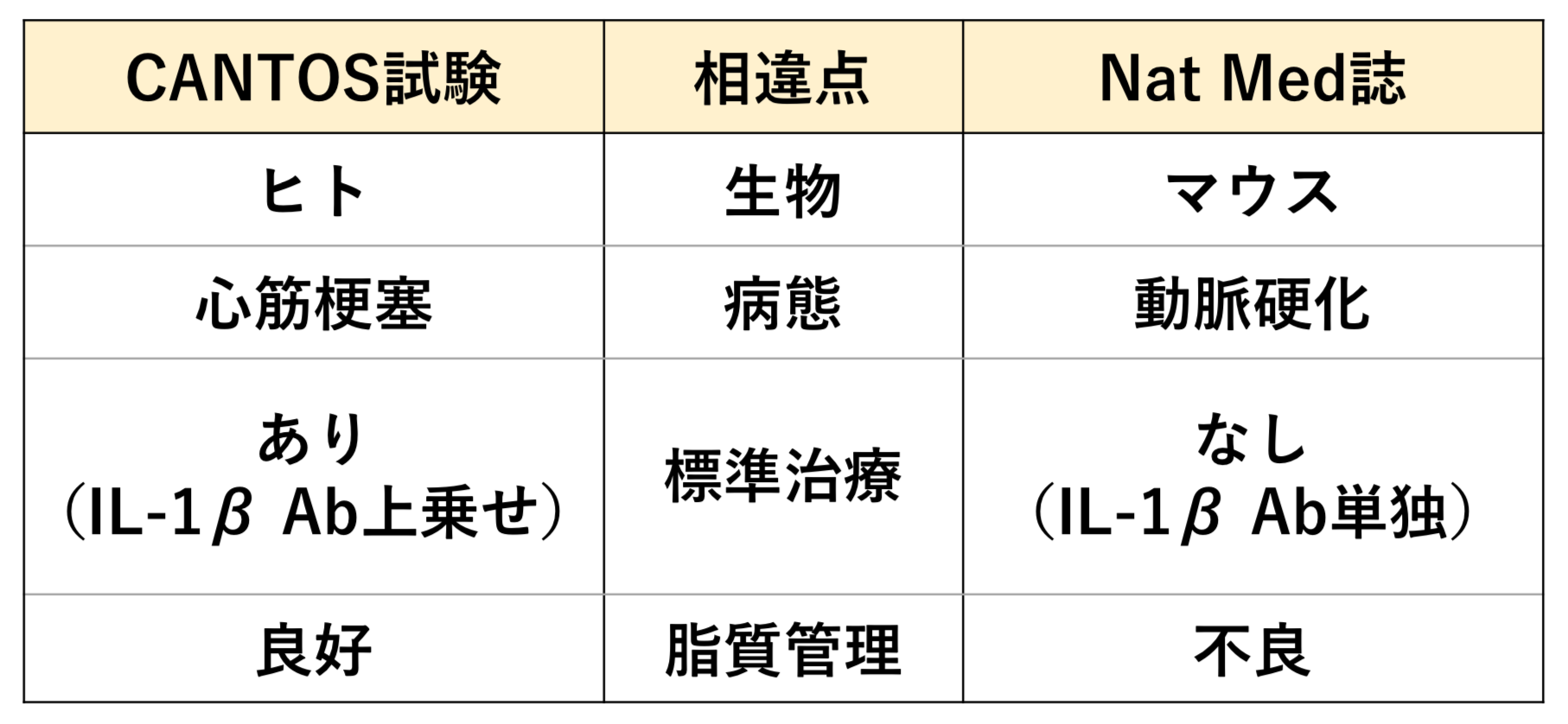
<新たな動脈硬化性疾患治療薬として注目されるIL-1β Ab>
2017年8月、IL-1β Abであるカナキヌマブの心血管イベント抑制効果を示したCANTOS試験の結果がNEJM誌に発表されました(文献1)。その後2018年1月にはLancet誌に(文献2)、同5月にはJACC誌に(文献3)、それぞれ有効性の高いサブグループを同定した追加解析結果が発表されており、現在循環器領域で最も注目を集めている次世代治療薬と言っても過言ではないでしょう。まずここでCANTOS試験について簡単に内容を説明します。
これまで、動脈硬化性疾患が慢性炎症により引き起こされる可能性は提唱されていましたが、実際に慢性炎症の低下が心血管イベントを抑制したというエビデンスは存在しませんでした。CANTOS試験は、高感度CRP 2.0 mg/L以上の心筋梗塞既往患者10,061名を対象として、IL-1βを阻害することにより抗炎症作用を発揮するカナキヌマブの心血管イベント抑制効果を検証したRCTです。結果としては、中央値3.7年の追跡期間で、カナキヌマブ150 mg使用群で一次エンドポイント(非致死的心筋梗塞・非致死的脳卒中・心血管死、図1A)および二次エンドポイント(一次+不安定狭心症入院)の抑制効果を認めました(文献1)。全死亡にはプラセボ群と有意差がありませんでしたが、その後の追加解析で、初回投与から3ヶ月後に高感度CRP <2.0 mg/Lを達成した反応の良い患者群では、心血管死・全死亡ともに低下したことが明らかとなっています(文献2、図1B)。
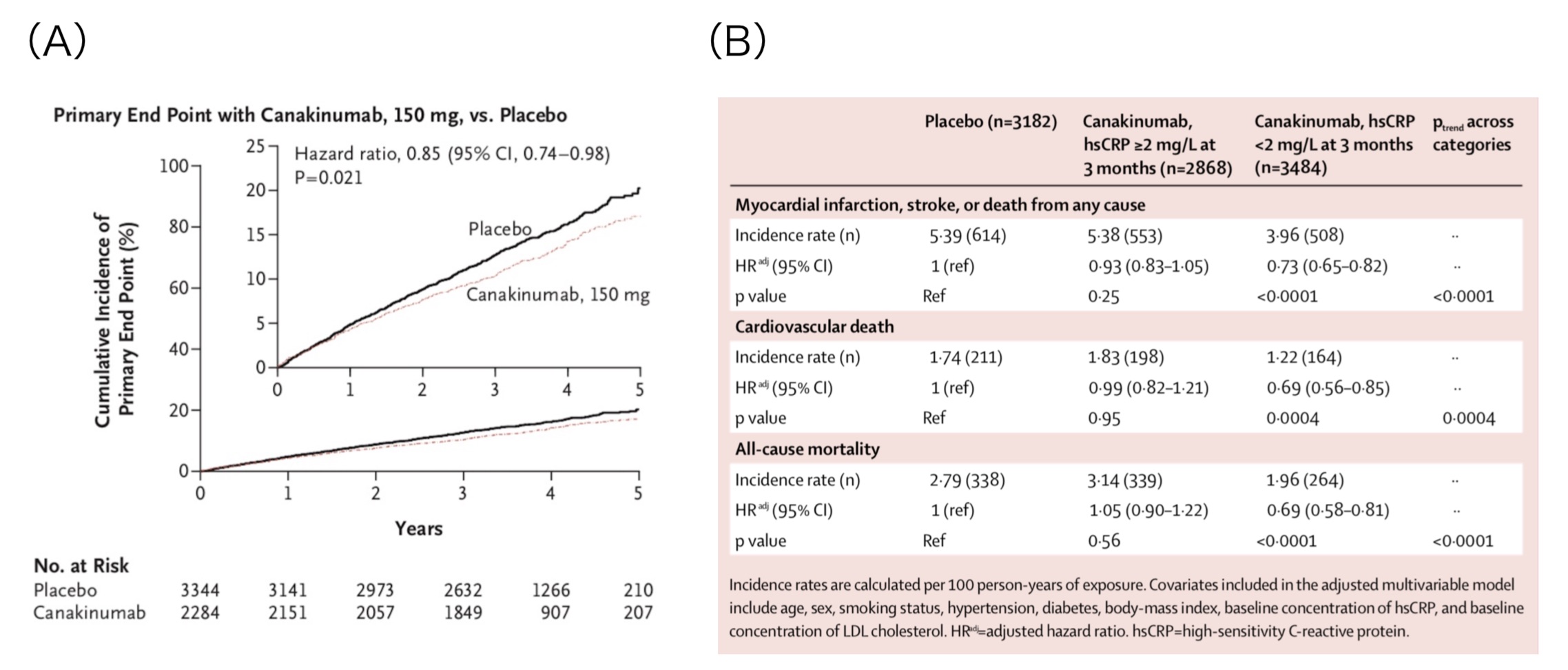
図1. (A) カナキヌマブ150 mg投与は一次エンドポイント発生を有意に抑制した(文献1) (B) カナキヌマブ投与3ヶ月後に高感度CRP <2.0 mg/Lを達成した反応良好群では心血管死・全死亡ともに有意に低下した(文献2)
<予想に反してIL-1β Abはプラークの線維性被膜を脆弱化させる>
それでは、IL-1β Ab投与によって、動脈硬化病変そのものにはどのような変化が起きているのでしょうか。そこで登場するのが冒頭のNat Med誌です。
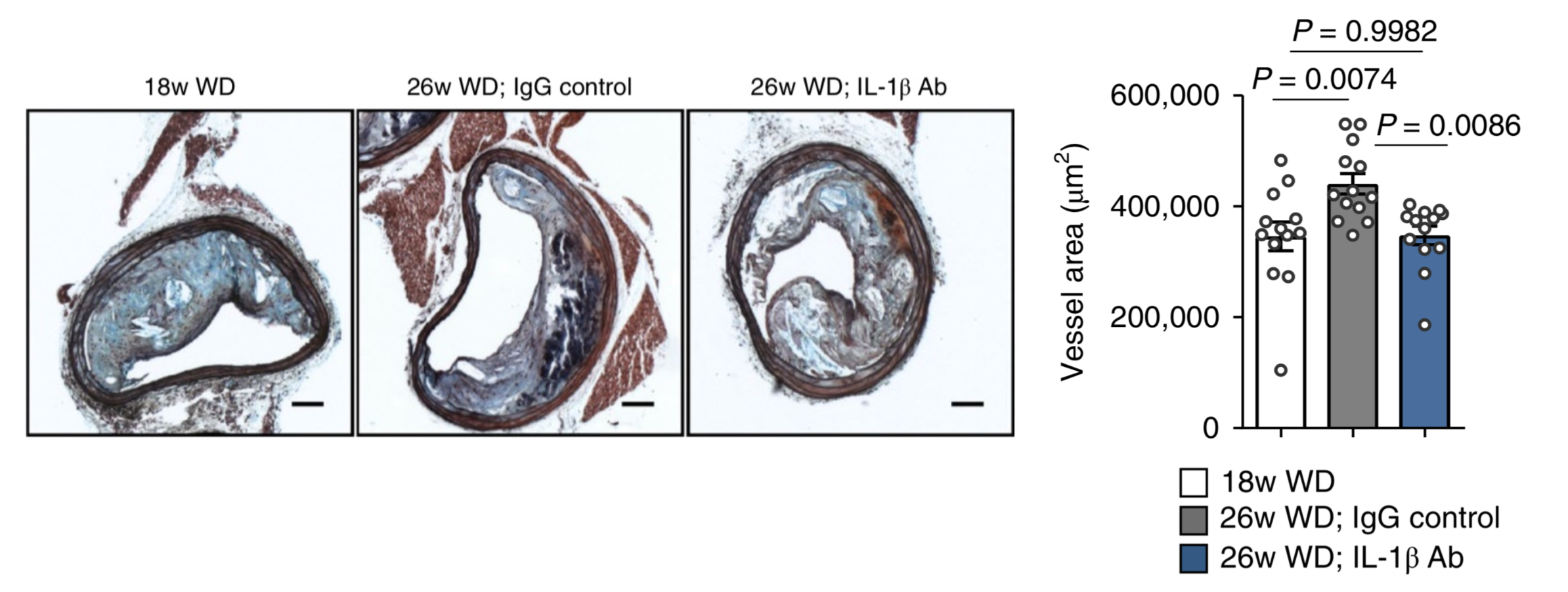
筆者らは、動脈硬化研究に汎用されるアポEノックアウトマウスに高脂肪食を与えてアテローム性動脈硬化を惹起し、その後IL-1β Abまたはプラセボを投与して、腕頭動脈切片を観察しました。その結果、予想に反して、IL-1β Abを投与したマウスではプラークの線維性被膜の脆弱化、すなわち①平滑筋細胞成分の減少(図2)、②マクロファージの増加(図2)、③コラーゲン成分の減少(図3A)、④菲薄化(図3B)が見られたのです。総じて、過度な炎症の抑制は、進行した動脈硬化病変においてはさらなる悪影響をもたらす可能性があると述べられています。これは先述の臨床試験結果と大いに矛盾します。
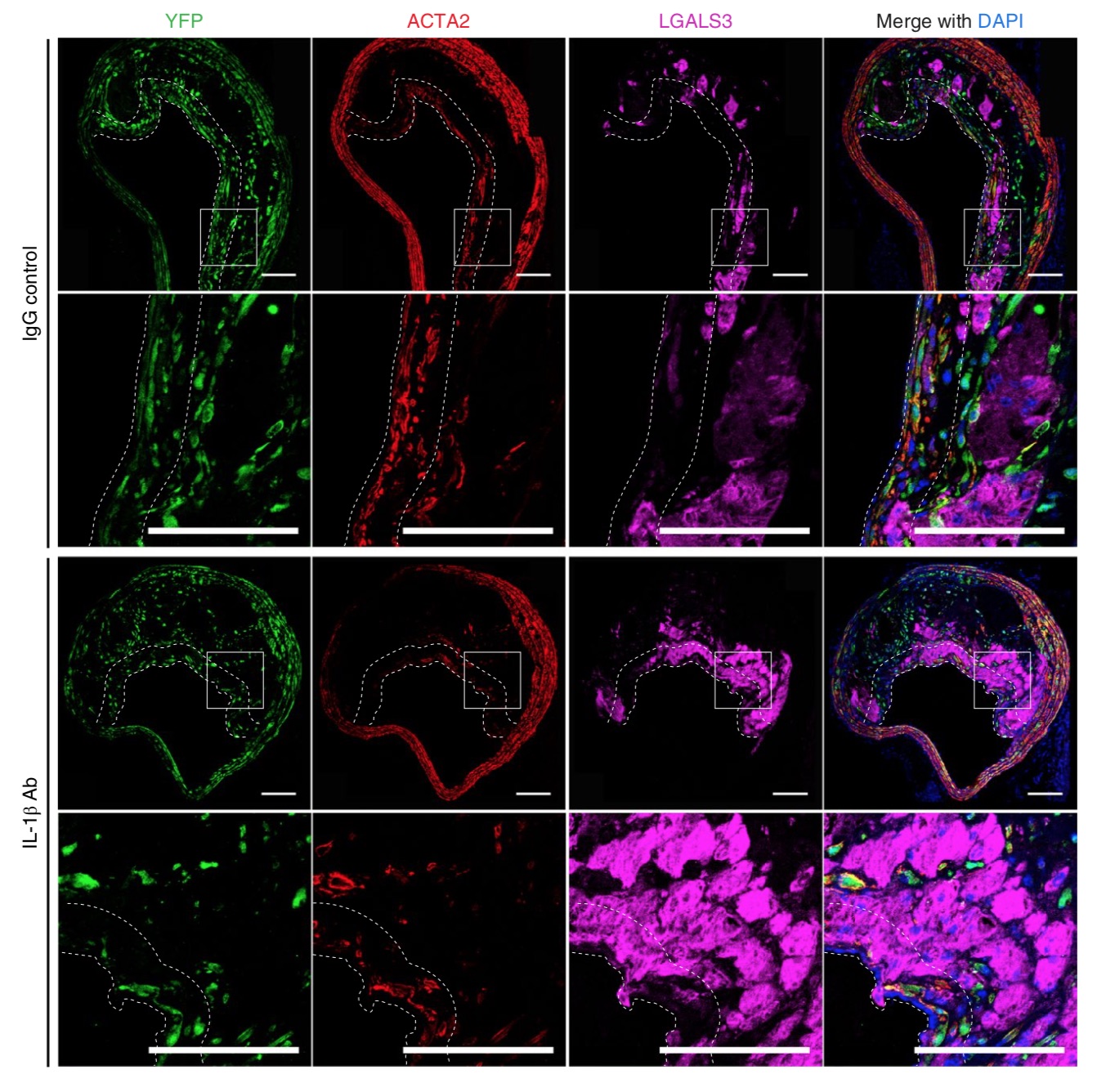
図2. マウス腕頭動脈切片の免疫染色(上2段: プラセボ投与群、下2段: IL-1β Ab投与群、それぞれ下段は線維性被膜部分の強拡大。YFP: 平滑筋細胞、ACTA2: 平滑筋細胞、LGALS3: マクロファージ、DAPI: 細胞核)
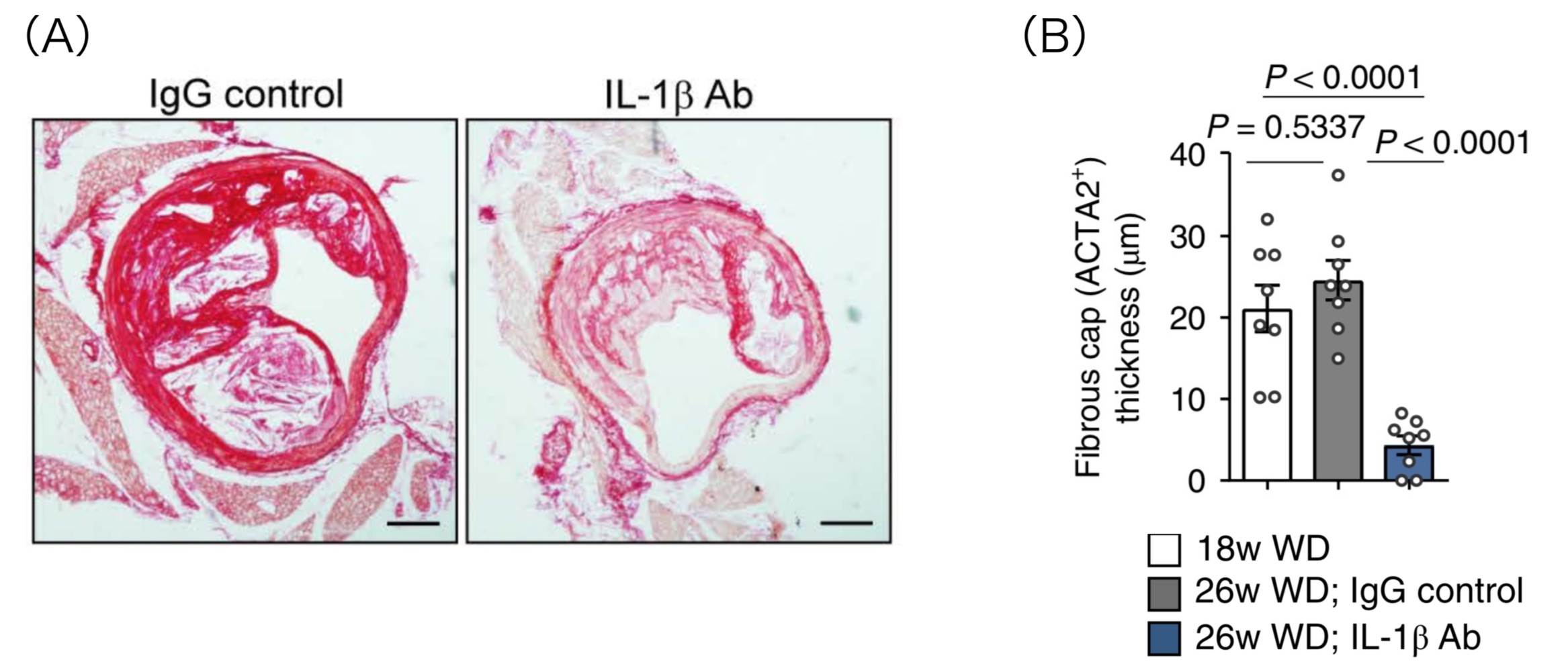
図3. (A) マウス腕頭動脈切片のシリウスレッド染色(濃い赤で染まるのがコラーゲン、左: プラセボ投与群、右: IL-1β Ab投与群) (B) プラーク線維性被膜の厚さ(左: 投薬前、中: プラセボ投与後、右: IL-1β Ab投与後)
<二つの研究の相反する結果をどう議論するか>
臨床試験でIL-1β Abの有効性が示された後に、同治療が動脈硬化に悪影響をもたらすという逆の結果が、権威あるNat Med誌から発表された意義は大きいと考えます。とはいえ、この両研究は対象に大きな隔たりがあり、結果を同列で比較することは当然できません(表1)。特に、CANTOS試験の対象はスタチンを含む標準治療によって良好な脂質管理がなされている、という点は結果の違いに影響を及ぼしうる重要な点でしょう。
一方、両研究には、それぞれの主義主張をまるごと素直には受け入れ難いと感じさせる、少数のデータが含まれています。例えばCANTOS試験では、一次エンドポイントにおける対プラセボ有意差はカナキヌマブ150 mg投与群でのみ検出されており、50 mg投与群及び300 mg投与群では検出されていないこと、またカナキヌマブ投与群ではプラセボ群より感染症・敗血症が有意に多く発生したこと、が挙げられます(文献1)。また、Nat Med誌の研究では、IL-1β Ab投与によって血管のポジティブリモデリングが抑制されており(図4)、筆者らはこの所見も線維性被膜の脆弱化と同じように、「動脈硬化病変に対する悪影響」と捉えています。確かに一理はあるのですが、循環器科医の立場としては、むしろポジティブリモデリングが起こっている方がプラークの不安定化に関連すると考えるわけです。それこそ、IL-1β Abを投与した冠動脈疾患患者で、血管内イメージングによってプラークの質的変化を観察することができれば、今ここにある疑問を解決してくれるのではないか、と考えを巡らせています。
カナキヌマブは日本でもすでに全身型若年性特発性関節炎などに対して承認されている薬剤です。SGLT-2阻害薬の昨今の流れに見られるように、ドラッグリポジショニングは新たな治療法の確立に非常に有効な手段ですが、臨床試験で新たな疾患に対する有効性が示唆された時に、「どうしてそうなるのか」をもう一度ベンチに立ち返って考える、というのはとても重要なことだと思っています。
<引用文献>
1. Ridker PM, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017; 377(12): 1119-1131.
2. Ridker PM, et al. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial. Lancet. 2018; 391(10118): 319-328.
3. Ridker PM, et al. Inhibition of Interleukin-1β by canakinumab and cardiovascular outcomes in patients with chronic kidney disease. J Am Coll Cardiol. 2018; 71(21): 2405-2414.