Transcatheter mitral valve replacementの現状
ボン大学ハートセンター 田中徹
今回は、経カテーテル的僧帽弁置換術の現状についてまとめさせていただきます。
僧帽弁のカテーテル治療のコンセプトはRepair (Edge-to-Edge repair やAnnuloplasty、Chords implantationなど)とReplacementの2つに分けられるかと思います。さらにReplacementについても大きく以下の2つに分けられます。
- Native の僧帽弁に対するReplacement
- 高度石灰化やリング形成術後, 生体弁置換後のReplacement
2はいわゆるValve-in-MACやValve-in-Ring, Valve-in-Valveと言われており、大動脈弁に用いられているバルーン拡張型人工弁のSapien弁を用いて治療が行われています。Native の僧帽弁に対する治療に関しては複数のデバイスがヨーロッパで使用可能となっています。デバイスのアクセスや治療コンセプトなどバリエーションに富んでいて、それぞれのデバイスのFeasibility trialの結果が報告されて来ています。いずれも良好な治療成績が報告されていますが、新たな問題点も指摘されています。
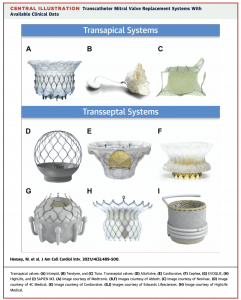 (J Am Coll Cardiol Intv 2021;14:489–500)
(J Am Coll Cardiol Intv 2021;14:489–500)
まずデバイスの種類ですが、上図のように2021年8月時点で9種類のデバイスで臨床試験が進行しています(1)。大きくTrans-septal approachとTrans-apical approachに分類されます。
Trans-apical approach のデバイスの中でも代表的なものとしてTendyneが挙げられます。Tendyneは心尖部からデリバリーカテーテルを挿入し、自己拡張型の人工弁を僧帽弁に留置します。特徴的なのがアンカーシステムで、人工弁の先端からポリエチレンのtetherが伸びていて、左室壁の心外膜側に留置するパッドで固定します。心外膜側からそのtetherのテンションを調整でき、術中にエコーで弁周囲逆流などを見ながら調整することが可能です。
Tendyneは2020年1月にヨーロッパでCEマークを取得し、上記の9種類のデバイスの中で最も早く臨床使用が可能となったデバイスとなります。初期のFeasibility studyでは109名の患者がエントリーされ、success rateは97.2%と高く、30日死亡は5.5%という結果でした(2)。しかし、trans-apical approachで、デリバリーシステムも34-36Frと大きいためか、重大な出血合併症が多く見られています(30日で19.3%)。このFeasibility studyのフォローアップは2年間まで完了しており、1年死亡は26%, 2年死亡は39%という結果で、1年および2年の時点ですべての患者でMRはmild以下にコントロールできていました。この結果をもってCEマークを取得することになり、現在はTendyneとMitraClipの前向き比較試験であるSUMMIT trialが進行しています。
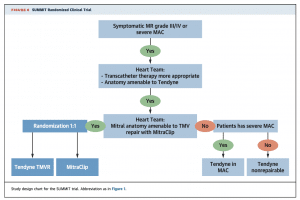 (J Am Coll Cardiol 2021;77:3058–78)
(J Am Coll Cardiol 2021;77:3058–78)
こういったTrans-apical approachのデバイスは操作性自体はシンプルですが、いくつか問題点が見受けられます。まず、上述のように出血性合併症が多くなります。MRの左室形態はASと違って左室肥大が目立たず、むしろ壁厚が菲薄化している症例が多く、同じTrans-apical approachといってもTAVIとは少し状況が異なります。さらに、穿刺部位も完全な心尖部ではなく、free wall側を穿刺することになるので、結果的に止血が難しく、どうしても出血性合併症が増えてしまいます。次に、カテーテル治療の最大の強みは侵襲度の低さにありますが、Trans-apical approachの侵襲度はtrans-septal approachと比較するとやはり大きくなってしまい、人工心肺は使用しないものの外科手術のデータに近い集中治療室滞在期間や周術期死亡率となってしまっています。
上記の問題点を解決するため、Trans-septal approachのデバイスにも注目が集まっています。Trans-septal approach のデバイスも大きく2つに分けられます。
- 人工弁に付属しているアンカーで弁下組織を挟み込んで固定
- 僧帽弁下部にリングを形成して、それをベースにして人工弁を固定
前者はCardiovalveやEVOQUEなどが代表的で、僧帽弁だけでなく三尖弁に対しても使用が試みられています。後者はHIGHLIFEやSapien M3などが知られています。Cardiovalve やEVOQUEなどはparavalvular leakを減らすために、弁輪に対してややオーバーサイジングになるように設計されています。一方で、HIGHLIFEやSapien M3はリングを形成して固定するため、デバイス自体は比較的小さくでき、デリバリーカテーテルを小径化することが可能になっています。また、デバイスが小さくなれば左室流出路狭窄などの合併症のリスクを軽減できることなどがメリットになります。しかし、僧帽弁下部のカテーテル操作はかなり複雑で難しい手技になり、腱索をからんでいないかなどをエコーで確認しながら進めていくので、時間がかかることなどがデメリットです。
Trans-septal approachのデバイスは、手技的にはハードルは上がりますが、侵襲度を考慮すると、将来的にはTrans-septal approachのデバイスに落ち着いていくのだろうと考えられます。いずれのデバイスもまだ初期の小規模な報告しかなく(3)、これからの報告が待たれます。
こういった経カテーテル僧帽弁置換術を行う際は術前のスクリーニング検査が非常に大切です。特に僧帽弁の解剖学的評価を行う上でCT解析が不可欠です(3)。主に評価が必要な点は下記の通りです。
- 僧帽弁のサイズ(弁輪面積・周囲長など)
- 左室流出路狭窄(LVOTO)のリスク評価
- 僧帽弁輪石灰化(MAC)の評価
僧帽弁のサイズはデバイス選択および人工弁のサイズを決める上で必要です。また、弁輪が大きすぎると適切にデバイスを留置できないため不適当となってしまいます。
LVOTOはカテーテル僧帽弁置換術の主要な合併症の内の一つで、事前にCTでリスク評価が必要です。LVOTOのリスク因子として、僧帽弁・大動脈弁との位置関係や左室中隔の肥厚、左室サイズなどが考えられています(4)。実際には、CT画像にvirtual valveを僧帽弁位に置くことで、新しいLVOT (neo-LVOT)を想定し、その断面積を計測します。Neo-LVOTの断面積が1.7-2.0 cm2以下だと弁留置後のLVOTOのリスクが高いとされ、カテーテル僧帽弁置換には不適当と判断されます。
このように術前のスクリーニング検査を行いますが、各デバイスの適応基準が厳しく、多くの症例がスクリーニングに回されるものの、スクリーニングの結果、不適当と判断され治療にまで至らないというのが現状となってしまっています。スクリーニング通過率はおよそ10-20%とされており(5,6)、私の所属するボン大学でもおよそ同程度の割合です。
スクリーニング不適当となってしまう理由として最も多いものは小さなNeo-LVOTであり、他には僧帽弁輪サイズやMACなどがあります。LVOTO高リスク群に対しては僧帽弁前尖を経カテーテル的に切断することでLVOTOを予防する手技も考案されています(7)。スクリーニング通過率を改善させていくことと、スクリーニングで脱落してしまうような症例をどのように治療していくか、などが今後の課題として考えられます。
このように、まだ発達途上ではありますが、カテーテル僧帽弁置換術は将来性のある治療だと思います。現在、日本では僧帽弁のカテーテル治療はMitraClipしか承認されていませんが、治療の選択肢は多い方がいいと考えています。MitraClipの応用性は高いといっても、やはりMitraClipが不向きの症例もありますので、僧帽弁の解剖学的特徴や患者背景、治療目標に応じて様々なデバイスを使い分けられればいいと思います。
外科的僧帽弁修復術はDegenerative MRに対しては非常に有効な手技であると考えられますが、すべての患者が修復術で治療できるわけではなく、弁置換術となる症例もあると思います。そういった症例はカテーテル僧帽弁置換術の良い適応になるかもしれません。また、手術リスクが高くカテーテル治療に回る症例でもdegenerativeなどMitraClipが不向きな症例でもカテーテル僧帽弁置換術の良い適応となりうると思います。
カテーテル僧帽弁置換術の治療成績が安定してくれば、MRの治療選択肢の棲み分けが見直されていくのではないかと考えられます。
- Hensey M, Brown RA, Lal S et al. Transcatheter Mitral Valve Replacement: An Update on Current Techniques, Technologies, and Future Directions. JACC Cardiovasc Interv 2021;14:489-500.
- Sorajja P, Moat N, Badhwar V et al. Initial Feasibility Study of a New Transcatheter Mitral Prosthesis: The First 100 Patients. J Am Coll Cardiol 2019;73:1250-1260.
- Alperi A, Granada JF, Bernier M, Dagenais F, Rodes-Cabau J. Current Status and Future Prospects of Transcatheter Mitral Valve Replacement: JACC State-of-the-Art Review. J Am Coll Cardiol 2021;77:3058-3078.
- Reid A, Ben Zekry S, Turaga M et al. Neo-LVOT and Transcatheter Mitral Valve Replacement: Expert Recommendations. JACC Cardiovasc Imaging 2021;14:854-866.
- Ludwig S, Ruebsamen N, Deuschl F et al. Screening for transcatheter mitral valve replacement: a decision tree algorithm. EuroIntervention 2020;16:251-258.
- Niikura H, Gossl M, Kshettry V et al. Causes and Clinical Outcomes of Patients Who Are Ineligible for Transcatheter Mitral Valve Replacement. JACC Cardiovasc Interv 2019;12:196-204.
- Khan JM, Babaliaros VC, Greenbaum AB et al. Anterior Leaflet Laceration to Prevent Ventricular Outflow Tract Obstruction During Transcatheter Mitral Valve Replacement. J Am Coll Cardiol 2019;73:2521-2534.
