心筋症のMRI (2)
心筋症の評価にMRIは有用であり、多くのエビデンスが蓄積されている。前回に引き続き、各心筋症に対するMRIの使用についてまとめる。今回はサルコイドーシス・アミロイドーシス・不整脈原性右室心筋症について述べる。
5. サルコイドーシス
6. アミロイドーシス
7. 不整脈原性右室心筋症 (ARVC)
5. サルコイドーシス
5-1. サルコイドーシスの遅延造影像(LGE)
心サルコイドーシスは、サルコイドーシスのなかでも高率に死亡原因となる。治療下での5年間での死亡率は、報告によるばらつきはあるが25-66%と高率である。[1]心筋生検による組織診断率はサンプリングエラーのため約20%と低く、画像診断の有用性が注目される。心サルコイドーシスのLGEの分布は心基部中隔や下側壁のみならず、左室・右室に多発するLGEを認めることも多い。Mid wall enhancement以外にも心内膜側や心外膜側など、LGEの分布パターンも様々である。LGEは炎症および線維化のいずれも陽性になることから、菲薄化・心室瘤化をきたす前の心筋病変を検出することが可能であり、早期診断に有用である。
Greulichらは、LGE陽性の心サルコイドーシスの心イベントリスクの高さを報告した。155名の全身性サルコイドーシス患者の心臓MRIを撮影し、中央値で2.6年の経過観察を行った。LGE陽性は25.5%で認め、LGE陽性患者は死亡・心停止からの救命、またはICD作動のリスクがHR=33.9倍になると報告された。LGE陰性の患者は肺炎による死亡1名を除き、いずれも心イベントを起こさなかった。[1]
5-2. サルコイドーシスのT1/T2 mapping
サルコイドーシスは心筋の炎症に伴い心筋浮腫を起こす。このためサルコイドーシスのparametric mapping評価では、T1 mappingのみならず、T2 mappingも注目される。Crouserらは全身性サルコイドーシス患者にLGEとT2 mappingを含めた心評価を行い、T2値はLGE陰性の患者でも延長していることを示した。[2] Greulichらは61名の左室収縮能の保持された全身性サルコイドーシス患者に対してLGE, T1 mapping, T2 mappingを行った。その結果、native T1の延長、ECVの拡大、T2値の延長を認め、正常例との比較ではnative T1とT2値に有意差が見られたと報告した。これらの患者のLGEは多くが陰性であった。彼らはこの結果から、サルコイドーシスが疑われた場合の心筋評価についてはまずLGE評価を行い、LGEが陰性であった場合にparametric mappingを行うことを勧めている。[3]
6. アミロイドーシス
6-1. アミロイドーシスのLGE
アミロイドーシスの予後予測にLGEは有用である。アミロイドーシスはlight chain (AL)アミロイドーシスとtransthyretin (ATTR)アミロイドーシスに分けられる。いずれも早期には心内膜側のLGEを認め、進行例では貫壁性を示す。Fontanaらは250名のアミロイドーシス患者(122名のATTRアミロイドーシス、9名の無症候性mutation career、および19名のALアミロイドーシス)のMRI評価で、LGEの領域の拡大とともに、収縮期血圧の低下、心電図変化(ATTRでPR延長とQRS延長)、NT-pro BNPの上昇、心形態の変化(左室心筋重量の増大、収縮末期容積の拡大、1回心拍出量の低下、EFの低下、左房拡大)、native T1とECVの延長を認めたと報告した。これら患者群のうち27%が24±13ヶ月のフォローアップ期間中に死亡したが、貫壁性のLGEはその有意な予測因子であった(HR: 5.4)。LGEの分布による2年生存率は、LGE陰性では92% (AL: 92%, ATTR: 94%)、心内膜下のLGEでは81% (AL: 81%, ATTR: 81%)、貫壁性では61% (AL: 45%, ATTR: 65%)であり、LGEの拡大に伴う予後悪化を報告した。[4]
6-2. アミロイドーシスのT1 mapping
T1 mappingではアミロイド沈着によりT1値およびECVの延長を示す。[5][6] アミロイドーシスもSCMRのConsensus reportでparametric mapping techniquesの有用性が証明されていると位置づけられ、使用が推奨されている。[6] 前述のFontanaらは、ALおよびATTRアミロイドーシスの両者において、LGE陽性の領域が広がるにつれてnative T1とECVが延長すると報告した。[4]
T1 mappingのパラメーターではECVが予後予測に有用と新しく報告された。Linらは82名のALアミロイドーシス患者のLGEとT1 mapping評価を行った。8か月のフォローアップ期間中に21名が死亡した。死亡の予後予測因子としてはLGEとECVが有用(global LGEでHR 4.804、ECV≥44.0% でHR 7.249)であり、またLGEの分布が同じグループ内ではECV≥44.0%だと予後不良であった(下図)。一方このスタディではnative T1は死亡の予後予測因子にならなかった。[7]
7. 不整脈原性右室心筋症 (ARVC)
7-1. ARVCの診断基準におけるMRI評価
ARVC Revised 2010 task force criteriaでは、診断基準の心機能異常評価や心形態評価の項目に新たにMRI評価が取り入れられた。[8][9]
7-2. ARVCの形態・機能・脂肪変性評価
ARVCの形態・機能評価には上記tasc force criteriaにもあるように、右室形態・機能の定量評価が必要である。右室は心エコーでは評価しづらいが、MRIでは問題なく評価可能である。脂肪変性の評価にはT1画像が有用である。脂肪抑制なしのT1画像で脂肪変性部位は高信号を認め、ARVCでは心外膜側からの脂肪変性が指摘される(図3)。右室側のみならず、左室側にも脂肪変性を認めうる。[9][10]
7-3. ARVCのLGE/ T1 mapping
線維化した心筋壁はLGEで高信号を示す。右室のみならず左室のLGEを認めることも多く、61%の症例に左室のLGEを認めたとの報告もある。[10] LGEの分布は不整脈治療の点からも注目される。特定の遺伝子異常(desmoplakin mutation)により左室の病変が早期に認められるという報告もある[11]。
ARVCに対するT1 mappingは、今回調べた限りではまだ報告が無かった。心筋の脂肪変性という特徴からはnative T1およびECVの短縮が予想されるが、今後の報告を期待したい。
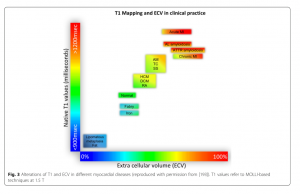
以下の図は前回も引用したが、今回も参照のために引用する。
References
1. Greulich S, Deluigi CC, Gloekler S, Wahl A, Zürn C, Kramer U, et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovasc Imaging. Elsevier Inc.; 2013;6: 501–11. doi:10.1016/j.jcmg.2012.10.021
2. Crouser ED, Ono C, Tran T, He X, Raman S V. Improved detection of cardiac sarcoidosis using magnetic resonance with myocardial T2 mapping. Am J Respir Crit Care Med. 2014;189: 109–112. doi:10.1164/rccm.201309-1668LE
3. Greulich S, Kitterer D, Latus J, Aguor E, Steubing H, Kaesemann P, et al. Comprehensive Cardiovascular Magnetic Resonance Assessment in Patients with Sarcoidosis and Preserved Left Ventricular Ejection Fraction. Circ Cardiovasc Imaging. 2016;9. doi:10.1161/CIRCIMAGING.116.005022
4. Fontana M, Pica S, Reant P, Abdel-Gadir A, Treibel TA, Banypersad SM, et al. Prognostic value of late gadolinium enhancement cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 2015;132: 1570–1579. doi:10.1161/CIRCULATIONAHA.115.016567
5. Maestrini V, Treibel TA, White SK, Fontana M, Moon JC. T1 Mapping for Characterization of Intracellular and Extracellular Myocardial Diseases in Heart Failure. Curr Cardiovasc Imaging Rep. 2014;7: 1–7. doi:10.1007/s12410-014-9287-8
6. Messroghli DR, Moon JC, Ferreira VM, Grosse-Wortmann L, He T, Kellman P, et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imagi. J Cardiovasc Magn Reson. Journal of Cardiovascular Magnetic Resonance; 2017;19: 75. doi:10.1186/s12968-017-0389-8
7. Lin L, Li X, Feng J, Shen K, Tian Z, Sun J, et al. The prognostic value of T1 mapping and late gadolinium enhancement cardiovascular magnetic resonance imaging in patients with light chain amyloidosis. J Cardiovasc Magn Reson. Journal of Cardiovascular Magnetic Resonance; 2018;20: 2. doi:10.1186/s12968-017-0419-6
8. Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/Dysplasia: Proposed modification of the task force criteria. Circulation. 2010;121: 1533–1541. doi:10.1161/CIRCULATIONAHA.108.840827
9. Te Riele ASJM, Tandri H, Sanborn DM, Bluemke DA. Noninvasive multimodality imaging in ARVD/C. JACC Cardiovasc Imaging. 2015;8: 597–611. doi:10.1016/j.jcmg.2015.02.007
10. Marra MP, Leoni L, Bauce B, Corbetti F, Zorzi A, Migliore F, et al. Imaging study of ventricular scar in arrhythmogenic right ventricular cardiomyopathy comparison of 3d standard electroanatomical voltage mapping and contrast-enhanced cardiac magnetic resonance. Circ Arrhythmia Electrophysiol. 2012;5: 91–100. doi:10.1161/CIRCEP.111.964635
11. Perazzolo Marra M, Rizzo S, Bauce B, De Lazzari M, Pilichou K, Corrado D, et al. Arrhythmogenic right ventricular cardiomyopathy. Contribution of cardiac magnetic resonance imaging to the diagnosis. Herz. 2015;40: 600–6. doi:10.1007/s00059-015-4228-0
12. Mahrholdt H, Wagner A, Judd RM, Sechtem U, Kim RJ. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies. Eur Heart J. 2005;26: 1461–74. doi:10.1093/eurheartj/ehi258
13. Captur G, Manisty C, Moon JC. Cardiac MRI evaluation of myocardial disease. Heart. 2016;102: 1429–1435. doi:10.1136/heartjnl-2015-309077

![図1 LGEの分布が同じグループ内のECVによる予後の違い 文献[7]より改変引用](https://sunrise-lab.net/wp-content/uploads/2018/01/Report-7-図1-300x98.png)
![表1 ARVC Revised 2010 task force criteria 文献[9]より部分引用](https://sunrise-lab.net/wp-content/uploads/2018/01/Report-7-表1-300x239.png)
![図2 脂肪抑制なしのT1画像による右室壁・左室壁の心外膜側からの脂肪変性 文献[9]より部分引用](https://sunrise-lab.net/wp-content/uploads/2018/01/Report-7-図2-281x300.png)
![図4 各疾患における遅延造影像(LGE)分布パターン 文献[12]より引用](https://sunrise-lab.net/wp-content/uploads/2018/01/Report-7-図4-263x300.png)
![図5 各疾患における遅延造影像(LGE)の代表例 文献[13]より改変引用](https://sunrise-lab.net/wp-content/uploads/2018/01/Report-7-図5-300x228.png)