大動脈弁狭窄症による心臓へのダメージ評価
最近自分のReviewがASに偏りすぎている気がしてなりませんが。懲りずにまたASの論文を取り上げさせていただきます。今回はASによる心臓への負荷の予後に対する影響をみた論文です。私の現在所属しているLUMCからの報告となります。
[1] Vollema EM, et al. Staging Cardiac Damage in Patients With Symptomatic Aortic Valve Stenosis. J Am Coll Cardiol 2019;74:538-49.
背景:
現行のガイドラインにおいて、ASのAVR適応はASの重症度と症状、左室収縮能低下(<50%)の有無によって定められている。ASの重症度は平均大動脈弁圧較差、弁通過血流速度、弁口面積などの心臓超音波検査によるパラメータで決定される。しかし、ASの臨床的予後は実際には大動脈弁の要素にのみ規定されてはいない。左室構造の変化のみならず、僧帽弁/三尖弁逆流、右心機能障害などがAVR後の予後規定因子として報告されている。近年、解剖学的/機能的な指標に基づいた心臓へのダメージ(Cardiac damage)のstagingが提唱されている。(Figure 1) PARTNER Ⅱ trialに登録された患者において、このstagingのTAVI後予後予測に対する有用性が報告されている。[2]
一方で非選択的な集団に関しての予後はまだ報告されておらず、そのため本研究では有症候性ASについてreal-worldのmulticenter cohortを用いてこのstagingの予後予測に対する有用性を検証することを目的とした。
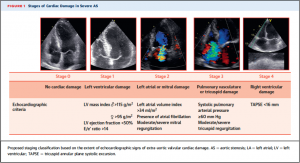 (Figure 1)
(Figure 1)
方法:
2施設 (Leiden University Medical Center [オランダ]とNational Heart Center [シンガポール])のon-going AS registryから1999-2017年に収集された有症候性severe ASのうち、baselineのエコーが使用可能であった 1,189例が選択された。Severe ASは平均圧較差≧40 mmHg, 大動脈弁口面積(AVA) <1.0 cm2もしくはAVA index <0.6 cm2, 最大弁通過血流速度≧4 m/secのいずれかを満たすものと定義された。
細かいエコーの方法については割愛します。
ステージングに関して。Baselineの経胸壁心エコーから、Figure 1に示される指標を用いて大動脈弁以外の心臓のダメージをStage 0-4に分類した。(Stage 0: ダメージなし、Stage 1: 左室のみ、Stage 2: 左房、僧帽弁への障害、Stage 3: 肺高血圧もしくは三尖弁への障害、Stage 4: 右室機能障害)
上記の基準のうち、基準を満たした最も悪いstageに分類し、各ステージの患者背景と予後を比較した。
Primary endpointは総死亡、secondary endpointは総死亡, 脳卒中、心臓関連の入院の合計とした。
結果:
Table 1は患者背景。全体の平均年齢は73±11歳、53%が男性であった。高血圧72%, 脂質異常症66%と多くの患者が心血管リスク因子を保有しており、冠動脈疾患の有病率も約半分(47%)に登った。NYHA Ⅲ度以上の患者は33%であった。それぞれのstageの内訳はFigure 2に示す通り、stage 0: 97例(8%), stage 1: 282例(24%), stage 2: 588例(49%), stage 3: 82例(7%), stage 4: 140例(12%)となっていた。進行したstageの患者では年齢、NYHA classと冠動脈疾患、心筋梗塞、心房細動の有病率が高く、低腎機能だった。また、利尿剤と抗凝固薬の内服率も高かった。
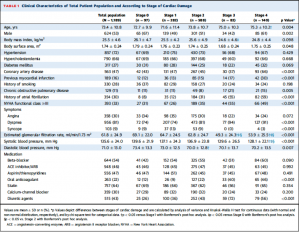 (Table 1)
(Table 1) 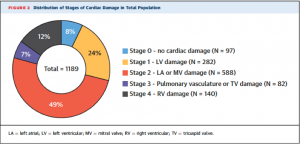 (Figure 2)
(Figure 2)
Table 2には心エコーの結果がstage別に示されている。全体のEFの平均値は54±14%, 心筋重量係数 (LV mass index)は133±40 g/m2, 平均大動脈弁圧較差 43±16 mmHg, 最高大動脈弁通過血流速度 4.1±0.7 m/sec, 大動脈弁口面積 0.78±0.18 cm2となっていた。Stage 3, 4の患者はlow-flow low-gradient AS患者の割合が高かった(それぞれ29%, 46%)ことを反映して、stage 0-2の患者と比較し平均台動脈圧較差と血流速度は低かった。
より進行したstageの患者ではEF低値、E/e’高値、左房容量係数 (LA volume indices)高値、有意な僧帽弁/三尖弁逆流の割合が高かった。
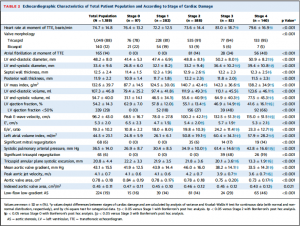 (Table 2)
(Table 2)
それぞれのstagingに用いられた要素の割合はTable 3に示されている。
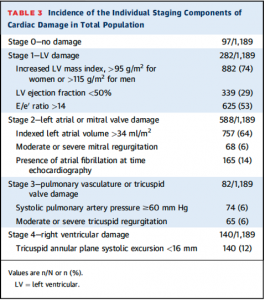 (Table 3)
(Table 3)
予後について。
917例(77%)がフォロー期間中にAVRを施行された(47% TAVR, 53% SAVR)。中央値42ヶ月のフォロー期間中に472例(40%)が死亡した。その他のeventについてはTable 4を参照。
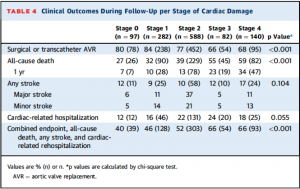 (Table 4)
(Table 4)
Figure 3には5年までのKaplan-Meier curveが示されている。Figure 3Aは全死亡、Figure 3Bは全死亡、脳卒中、再入院の複合イベントに対する図となっている。いずれもstageが進行するに従ってイベント発生率は高くなっており、特にstage 2以上では有意にstage 0, stage 1と比較し予後が悪かった。AVR後の患者のみでのサブ解析でも死亡、複合イベントについて同様の結果であった。
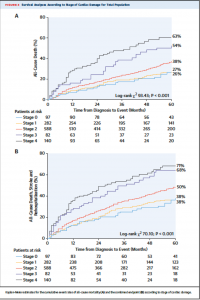 (Figure 3)
(Figure 3)
Table 5には死亡と複合エンドポイントについての関連因子について単変量/多変量解析が示されてる。多変量解析では年齢、心筋梗塞既往、AVR、心筋ダメージstagingが死亡率と関連していた。stagingは一段階上がるごとに28%のリスク増加と計算された。また、stage 3 (p=0.018)、stage 4 (p=0.001)は多変量解析において独立して全死亡と関連していた。
複合エンドポイントに関してはそれらに加えeGFRも関連していた。Stagingごとのリスク増加は19%であった。また、stage 2 (p=0.049)、 stage 3 (p=0.018)、stage 4 (p=0.002)は独立して複合イベントと関連していた。
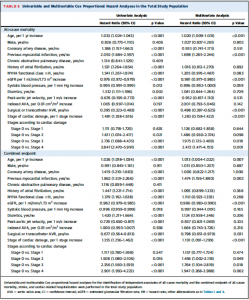 (Table 5)
(Table 5)
考察:
本研究の最も重要な結果は、real-worldの非選択的有症候性ASコホートにおいて疾患弁以外の心臓ダメージが高率に存在し、全死亡と複合エンドポイントに独立して関連していることを示したことである。
重症ASはまず石灰化弁と弁口の狭小化による慢性的な圧負荷から代償的に左心室の中心性肥大を引き起こし、左室収縮能、拡張能低下を生じる。この時点で多くの患者は症候性となり、AVRの適応となると考えられる。しかし、ASの影響は左室のみに留まらず、左室充満圧の上昇は左房の拡大とリモデリング、さらには心房細動や僧帽弁閉鎖不全症のリスクを上昇させる。続いて左房圧の上昇が肺動脈圧上昇を引き起こし、三尖弁閉鎖不全症、右室リモデリングを経て最終的に右心不全へと至ると考えられている。
これまで様々な研究においてA弁以外の心臓ダメージについての報告がなされてきた。心房細動はSAVR患者の8-13%, TAVI患者の51%、有意なMR/TRはそれぞれ13-20%, 11-27%、肺高血圧はSAVR患者の10%, TAVR患者の36%、右室機能低下は24-29%と報告されている。
先行研究[2]では、TAVR後の1年followにおいてこのstagingが死亡率と関連していることが示されている。本研究はさらにreal-worldでの長期予後 (follow期間中央値 42ヶ月)に対してstagingの有効性を示したと考えられる。これらの要素は現在のリスク予測モデルに採用されておらず、今後の有症候性ASの予後予測に対する有用性を確立するために前向きのrandomized trialが必要であると考えられる。
Retrospective studyである点、左室収縮障害 (LVEF <50%)の影響が先行研究[3]と比較し少ない点、TRのsubtypeは分類されていない (心房細動によるものなのか、それとも肺高血圧によるものなのか)点、右室機能障害はTAPSEのみで評価されていることなどがlimitationとして挙げられている。
私見 (一部感想):
自分の所属している施設からの論文ではあるものの、2施設でMulticenter studyと言い切る感じはすごいなと思いました。
Methodとしては非常にシンプルだし、予後データも大変きれいに層別化されているので今後こういった弁以外の指標が重要になりそうです。現にこれまでの研究から、ガイドラインにLVEF低下の有無が追加されており弁の重症度以外の項目が治療適応に反映される方向になってきております。そのため、これらの指標が今後ガイドラインなどに収載される可能性は高いだろうと思っています(というよりガイドライン作っている人たちが論文を出していますから既定路線なんでしょうね)。
もちろん、このstagingの詳細に関しては今後議論が必要となると考えられます。左房大きくなくても右心系が悪い人、心房細動やCOPDなどでASとは別に右心負荷や心房拡大を起こす人などがいるので、このような人にもstagingが適用できるかといった問題はありますが、原因が何かはともかくとして大きな集団で考慮すればこのstagingが正当にリスク評価に有用である可能性が示されたのではないかと思います。しかし一方で、手技前に測定しなければならない項目や必要な検査がどんどん増えてきていてどこまでいくのかな…と思ったりもしています。
無症候性ASについての報告も同時にJACCに掲載[3]されており、こちらも比較して参照いただくと面白いかもしれません。
参考文献:
[1] Vollema EM, et al. J Am Coll Cardiol 2019;74:538-49.
[2] Généreux P, et al. European Heart Journal 2017;38:3351-58.
[3] Tastet L, et al. J Am Coll Cardiol 2019;74:550-63.
