MitraClip®における肺静脈波形の重要性について
今回は僧帽弁逆流に対するMitraClip®において、肺静脈波形の変化が予後に与える影響についての論文です。ちょっとマニアックかもしれませんが当施設の抄読会で結構議論になったので取り上げてみました。
[1]Corrigan III FE, et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 2019;12:1905-13.
さて、皆様の施設では肺静脈波形(PV flow)をどのくらい重要視しているでしょうか。Routineで撮っている施設、撮っていない施設、経食道エコーでだけとる施設、色々あると思います。いまいちPV flowが臨床に浸透していない原因は(心エコーご専門の先生方に怒られるかもしれませんが)何のために使ってるのかよくわからないところだと思います。まずは波形について復習から。
次に示すのが正常のPV flow wave。収縮期波はS1, S2波に分かれており、拡張期波はD波、心房収縮期に心房収縮による逆流波(AR波)が観察されます。S波とD波は正常では順行波です。
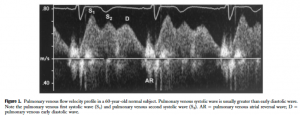 ([2]より引用: 正常肺静脈波形)
([2]より引用: 正常肺静脈波形)
そもそも以前は左室拡張能障害の指標としてPV flowは使用されてきました。下の図は専門外でも皆様どこかでみたことある図ではないでしょうか。[3]四段目がPV flowです。左房の入り口の波形ですから、左房圧を反映して波形が変化するのは理解しやすい部分だと思います。
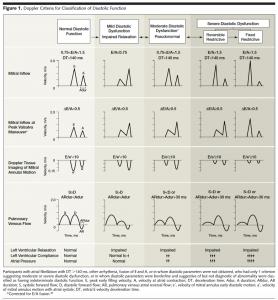 (文献[3]より引用: Doppler法による拡張能評価基準)
(文献[3]より引用: Doppler法による拡張能評価基準)
ただ、PV flowの問題点は様々な指標を含んでしまっているがためにそれだけでは何を表現しているかわからない、というのが複雑な点です。ざっと挙げるだけでも左房コンプライアンス、左室/左房の収縮/拡張能、測定時の血行動態、そして僧帽弁逆流などの要素が関わってきます。
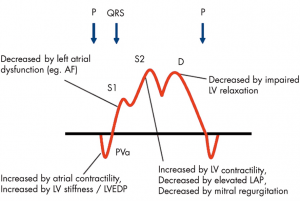 (文献[4]より引用: PV波形に関連する因子)
(文献[4]より引用: PV波形に関連する因子)
そのため、ASEから2016年に発表された拡張能評価ガイドライン[5]でもアルゴリズムに含まれない要素となってしまっています。ただ逆にそれだけの要素を含んでいるからこそ、PV flowの予後評価についての有用性に関しては気になるところかと思います。
さて、僧帽弁逆流症例において、その波形がどうなるかに関しては次の図をご覧ください。
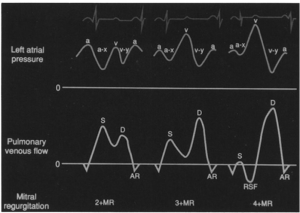 (僧帽弁逆流重症度によるPV波形の変化: 文献[6]より引用)
(僧帽弁逆流重症度によるPV波形の変化: 文献[6]より引用)
注目すべきはS波です(MRが収縮期なんだから当たり前か)。MRが重症化するにつれ、S>D→S<D→reverse Sの出現と波形が変化していきます。この変化が今回の論文のキモです。
だいぶ長くPV flowの解説に費やしましたが、ここからが本編。
背景:
MitraClip®は現在のところ手術リスクの高い有症状の重症MRに用いられている。今までの研究では、MitraClip®後の僧帽弁平均圧較差上昇(transmitral gradient≥5 mmHg)が長期予後に関わること、急性期の左房圧(LAP)低下が6分間歩行距離の改善に繋がったことなどが示されている。一方で術中の血行動態指標の予後評価における有用性に関してのエビデンスは少ない。今回の研究ではMitraClip®手技中のパラメーター(MR重症度の変化, transmitral gradient, LAP, V波など)の予後予測に対する有用性に関して検討した。
方法:
2013年5月-2017年1月にEmory University Hospital(Atlanta, Georgia, US)にてMitraClipによる僧帽弁形成(PMVR: percutaneous mitral valve repair)を行った121例の連続症例について後ろ向きに解析が行われた。薬剤治療抵抗性の有症候性MRであり、Heart teamによりPMVRが適切と判断された症例がエントリーされた。うち6例は画像不良、手技不成功、僧帽弁狭窄の出現などで除外されています。Follow-upは施設のheart teamの外来経過記録、電話でのインタビュー、Public recordsなどから収集された。一次エンドポイントは全死亡、複合イベント(死亡、LVAD装着、僧帽弁手術、再度のPMVR)とし、二次エンドポイントは治療後30日、1年での再入院とした。
エコー評価の方法に関して。術直前の経食道エコーにて全身麻酔下にMR重症度、僧帽弁圧較差、右上肺静脈(RSPV), 左上肺静脈(LSPV)の波形が評価された。MitraClip®留置後、MR重症度、僧帽弁圧較差、両PV波形が評価された。PV波形はS波の形状により“normal”, “blunted”, “reversed”と段階的に評価された。術前に悪かった方のPV波形のみが解析において使用された(つまり、術前評価でより悪かった方のPV波形と同じPVについて術後評価された)。段階が改善した場合にPV波形の改善(improvement)と評価された(Figure 1)。
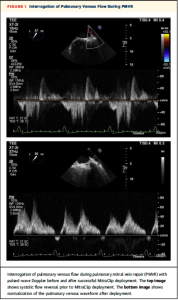 (Figure 1)
(Figure 1)
結果:
115例(平均年齢76±12歳)が解析され、87%がNYHA 3 or 4の心不全を有していた。64%が器質性MR, 36%が機能性/混合性MRであった。留置されたClipは平均1.5±0.6個であった。手技合併症としては6例で輸血を要する出血イベントが認められた。術後30日時点での死亡は9例(8%),術後 1年時点では27例(23%)で認められた(Table 1)。
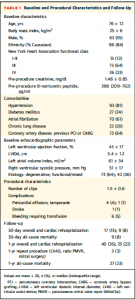 (Table 1)
(Table 1)
115例のうち92例で術前、術後に解析可能なPV flowが得られた。手技中の血行動態の変化として、僧帽弁圧較差は上昇 (2.1→3.6 mmHg), 左房圧低下 (23→19 mmHg), V波低下 (43→28 mmHg)が認められた。術前のS波に関しては45例(49%)は右上肺静脈で低く、47例(51%)は左上肺静脈で低かった。PV flow S波速度は術後に改善を認めた(-27→37 cm/sec)。S wave reversalは術前に58例(61%)で認めていたが、術後は3例(3%)のみであった。
術後のMR重症度改善の程度(MR gradeがどれだけ下がったか)により分類した2群によるK-M curveでは、24ヶ月の死亡率について有意な差を認めなかった(Figure 2)。
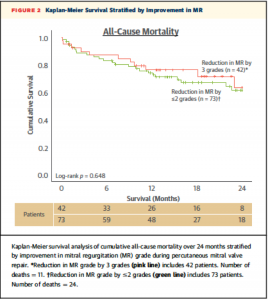 (Figure 2)
(Figure 2)
一方でPV flow波形が改善したか否かによる2群に分類したK-M curveでは術中にPV波形が改善した群において有意に生存率が高かった(Figure 3, Logrank P < 0.001) 。本文中には図は示されていないものの左房圧V波の改善や僧帽弁圧較差上昇(transmitral gradient ≥5 mmHg)について行ったK-M analysisでは有意な差を認めなかったとのこと。
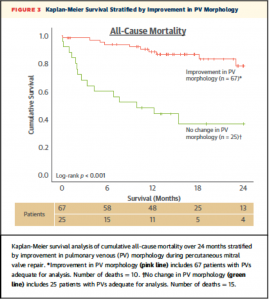 (Figure 3)
(Figure 3)
続いて、全死亡、複合エンドポイントに関して術前の慢性肺疾患の有無、血清クレアチニン値、BNP値で調整したProportional hazard modelを用いて単変量解析を行った(Table 2) 。V波の低下は全死亡、複合エンドポイントの両方に関連していた。また、僧帽弁圧較差の上昇は全死亡と関連しており、MR重症度の有無は複合エンドポイントに関連していた。肺静脈波形に関するパラメーター (S波の変化、S/D波の比の変化、PV波形の改善有無)はそれぞれ全死亡、複合エンドポイントの両方に関連していた。
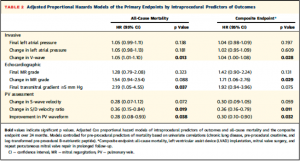 (Table 2)
(Table 2)
PV波形の改善があった群となかった群でbaselineのパラメーターを比較すると、PV波形のなかった群ではBNP,慢性肺疾患の有病率が高かった(Table 3)。
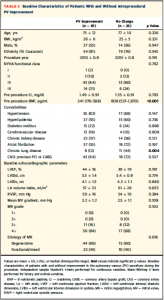 (Table 3)
(Table 3)
24ヶ月時点での死亡率におけるROC解析では、肺静脈波形パラメーターは侵襲的パラメーター、他のエコーパラメーターと比較し有意に高い正確性を示した (Figure 4)。
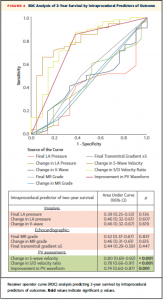 (Figure 4)
(Figure 4)
Table 4では慢性肺疾患、BNP値、クレアチニン値を用いたbinominal logistic regression modelにより、二次エンドポイント (30日/1年時での再入院、心原性の要因での再入院)について関連因子を解析した。有意な結果を全部記載すると大変なので、表を参照。PV波形の改善は1年時の再入院、30日/1年時での心原性再入院に関連していた。
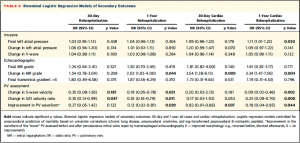 (Table 4)
(Table 4)
考察:
今回の研究で筆者らはPV波形の改善がMitraClip®後の長期予後に関連していることを示した。
MitraClip®において実臨床では様々なパラメーターが測定されているが、それらの重要性、正確性についてはいまだに確立されていない。カラードップラーによる評価はデバイス自体のacoustic shadowや偏在性のjetによる角度依存性の問題から困難であり、さらには心房、心室の負荷に左右される。3Dエコーもこれらの問題点を解決するに至っていない。残存逆流の評価についても、一般的に用いられているvena contractaの測定などの信頼性は不十分である。
観血的な圧測定はエコー特有の問題点には左右されないものの、全身麻酔下での測定となり、心房、心室の負荷に影響される点は同様である。また、持続的な左房圧モニタリングは手技を煩雑にする可能性がある。新しいMitraClip NT systemでは左房圧の持続モニタリングが可能となっているが、圧波形のダンピングが報告されており信頼性については疑問が残る。
PV波形の変化は他の検査と同様に心負荷に左右されるが、S/D比や波形の改善を確認することでS波単独よりも良い予後予測指標となった可能性がある(Table 2) 。また、角度依存性の問題もS/D比や波形の変化を用いることで解決することができると筆者は述べている。
Primary MRとsecondary MRに分けて解析した場合でも、PV波形の改善は良好な予後と関連していた。また、心房細動症例と洞調律例に分けて解析した場合でも同様であった(Supplement figure 1, 2にありました。今回は添付していません)。
何れにしても、PV flowは本研究において、長期の生存率や再入院率を予測できる可能性を示しており、他の指標よりもPMVR手技中の手技成功を判断する良い指標となる可能性がある、と筆者らは結論づけている。
私見:
今回の論文に関して我々の施設の抄読会でも度々指摘があったのが、「目の付け所は素晴らしいけど方法が微妙」という点です。Methodsに関してはもう少し工夫できたのではというのが正直な感想です。いくつか指摘しますと
1) 最初のbaselineで示されているのが最初の115例であるのに対して、予後評価がなされたのが92例。これなら最初からその92例のbaselineを示すべきではないか。
2) Figure 4のROC curve、PV flow wave formの有用性を示したいのは理解できるが、V波の変化やPV flowの変化など、categoricalな変数に対して用いるのは不適切ではないか。
3) 術後の残存MR重症度の評価方法の記載がない。これがわからないとFigure 2のK-M curveの信頼性が低い。
4) 治療前はRPV, LPVの両方が評価されているのに対して、治療後は一方(術前により波形が悪かった方)のみが評価されている。どちらかに統一するか左右両方を評価すべきではなかったか。
5) PV waveの変化についてnormal、blunted、reversedと段階的に評価されているがそれぞれが何例ずつ、治療後が何例ずつになったのかが不明。
6) なぜ慢性肺疾患、BNPの他にクレアチニン値でも調整したのか。
同僚のイタリア人はこれがJACC cardiovasc imagingにacceptされていることに驚きを隠せない様子でした。そして私のボスもなかなかキツイ感想でした。そもそもうちのボスはROC curveを毛嫌いしています。何か悪い思い出でもあるのでしょうか。
実はこの論文の直後にJACC interventionにMitraClip®後PV flowの有用性に関する同様の論文[6]がpublishされています。Cedars-Sinai Medical Center (Los Angeles, USA)からの報告です。こちらはS波、D波をQuantitativeに評価しており、症例数も300例と多めです。こっちが先にacceptされていたら今回の論文はacceptされていなかったかも…タイミングって重要ですね。ただ、どちらにしてもおそらくPV waveの変化が予後に影響することは示されており、有用性はあるかと思います。これまであまり興味のなかった方も、ぜひPV flowについてもう一度勉強し直すと何か新しい発見があるかも…
イスラエル人の同僚がPV flowに興味を持っているようであり、今後LUMCからも何らかの報告が出ることを期待して待とうと思います。
References
[1] Corrigan III FE, et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. J Am Coll Cardiol Img 2019;12:1905-13.
[2] Tabata T, et al. Pulmonary Venous Flow by Doppler Echocardiography: Revisited 12 Years Later. J Am Coll Cardiol 2003;41:1243-50.
[3] Redfield MM, et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003;289:194-202.
[4] Mottram PM, et al. Assessment of diastolic function: what the general cardiologist needs to know. Heart 2005; 91: 681-95.
[5] Nagueh SF et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2016;29:277-314.
[6] Klein AL et al. Effects of mitral regurgitation on pulmonary venous flow and left atrial pressure: an intraoperative transesophageal echocardiographic study. J Am Coll Cardiol 1992;20:1345-52.
[7] Ikenaga H, et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes after Percutaneous Mitral Valve Repair with the MitraClip. J Am Coll Cardiol Intv 2019;12:140-5.
