Cardiovascular interventionの分野で最も熱い領域の一つ
1. TAVI (Transcatheter Aortic Valve Implantation; 経カテーテル大動脈弁留置術)
自分が留学を開始した2013年3月の時点で、すでにTAVI開始後10年ちょっとが経過していた。ゆえに、ここヨーロッパでは「成熟期」に入っており、Transfemoral (TF)-TAVIは通常のカテ室にて局所麻酔で行われる「ルーチン」の治療の一つとなっている。少なくとも、ドクター、ナース、MEには特別な治療という緊張感は全くない。とは言うものの、基本18 Frシースをベースとしているこの手技では、血管合併症のリスクは避けられない。幸か不幸か、こちらに来て多くの(!?)血管合併症に遭遇し、その対処法を学べたのは貴重な経験であったと言うべきであろう。そんなTAVIの治療をさらに一歩先に進めたのが今回紹介するSapien 3 (S3)というEdwardsの最新のValveである。Valveのデザインも去る事ながら最も特筆すべきはデバイス/シースのLow-profile化である。23 mm、26 mmのvalveに関しては14 Frシース(eSheath)を使用できる。我々の施設もようやく9月から導入したが、18 FrシースをAortaまで進めていたときと比べて、14 Frシースを進めていくときの抵抗の少なさには本当に驚かされた、まさに感動ものである。
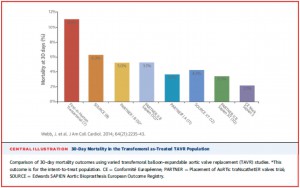
今回、紹介する論文はSapien 3というtrialである(NCT 01808287; J Am Coll Cardiol 2014;64:2235-32)。ヨーロッパとカナダの16施設で前向きに150人のhigh-あるいはintermediate-riskの重症大動脈弁狭窄症患者に対して、S3を留置し、その安全性および手技成功率を評価したstudyである。患者の平均年齢は83.6歳、STS scoreは7.4、TF-TAVIは64%の症例において施行された。治療後30日の時点で、96.4%がno-mild PVR(paravalvular regurgitation;弁周囲逆流)、moderate PVRが3.5%、severe PVRの患者はいなかった。TF-TAVIに限って言えば、30日の死亡率は2.1%(図1)、その他のアクセスルート(transapical/direct aortic;経心尖部/経大動脈アプローチ)の死亡率はより高かった(11.6%)。8割弱の患者が23 mmおよび26 mmのS3を留置されており(すなわち14 Fr eSheath)、major vascular complicationが4.2%と低かった一方、新規ペースメーカー植込みは13.3%と従来のバルーン拡張型弁の成績に比べ、高めであった。新規ペースメーカー植込み率が高かったのは、S3のデザインによるところが大きいだろう。Valveのサイズにもよるが、Sapien XTに比べてS3の方が3-4 mm背丈が高い。つまり、Sapien XTと同様に留置するとValveがより左心室側に位置することになり、結果として刺激伝導系に影響を与えたものと考えられる。このような知見もあり、現在、我が施設でもS3留置時にはより大動脈側に留置するように心がけている。当然、冠動脈の高さ、留置するValveのサイズなどにより個々の患者での留置位置は変わってくる。
Sapien 3のtrialをまとめると、
1) 30日のoutcomeは非常に良好であった。
2) 96.4%の患者がmild以下のPVRであった。この患者背景により軽度のoversizing (< 7%)に抑えられる結果が得られたことが、Sapien XTと大きく異なる点である。
3) 新規ペースメーカー植込み率はやや高かった。
4) Intermediate riskの患者、また末梢血管の状態のよくない患者(このstudyにおけるTF-TAVI群の最小血管径は6.6 mm)に対して、S3によるTAVIが外科的大動脈弁置換術の代替治療として有効であることを示唆するものである。
このstudyの結果をふまえて言えることは、2013年10月から導入された日本でのTAVIの成績が極めて良好、ハイレベルである、ということである(Sapien XT使用にも関わらずS3とほぼ同等ないしそれ以上の成績は驚異的である)。患者選択、手技技術、術後管理、すべての過程における日本の先生方、ハートチームの努力の賜物であろう。非常に誇りに思える結果である。
2. MitraClip
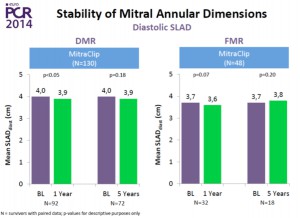
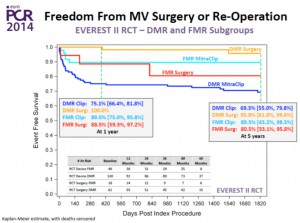
2014年のEuroPCRにて、EVEREST II trialの5年の成績が発表された。ちなみに、EVEREST II trialは、重症僧帽弁閉鎖不全症(MR)の患者を、MitraClipによる治療群と外科的僧帽弁手術群に無作為に分け、治療効果と安全性を比較した試験である。5年の結果は、degenerative MR (弁変性によるMR)、functional MR(機能性MR)いずれにおいても、持続したMRの軽減、持続した左室容量の改善(LV reverse remodeling)および持続したNYHA機能分類の改善、を示した。個人的に興味深かったのは、ベースラインと5年後で僧帽弁の弁輪径がほぼ変わらなかったことである(図2)。弁輪形成術を伴わないMitraClip単独治療の限界点として、経時的に弁輪拡大を生じ、結果として、MRの再増悪を招く恐れを指摘されていたからである。少なくとも治療後5年までに関しては、治療直後のMR軽減が良好であれば、持続していい結果が得られることがこの試験により証明された(図3)。一方、5年後以降の成績はどうなのか?それは、誰もが知りたいことであるが、まだ未発表のため明らかではない。ただその答えのヒントになるかもしれないのが、今回紹介する次の論文である。
Long-Term Results of the Edge-to-Edge Mitral Valve Repair Without Annuloplasty in Degenerative Mitral Regurgitation (Circulation;130:S19-24)
この論文では、degenerative MRに対して弁輪形成術なしの単独edge-to-edge repairを施行された患者61名を長期(平均9.2年、最長18.1年)にわたりフォローし、retrospectiveに解析した結果を報告している。ちなみに、これら61名の患者で弁輪形成術が施行されたなかった理由は、1) 重度の弁輪石灰化(36名)、2) 弁輪拡大を認めなかった(25名)、である。術後12年の時点で、再手術回避率は57.8%、MR3度以上の再発回避率は43%ととても満足のいく結果ではなかった。特に、弁輪石灰化の症例で、退院時すでに1度以上のMRを認めていると5年までの成績は不良であった。術後残存MRが1度以下であれば、MR3度以上の再発回避率は5年で80%、10年で64%となっており、MitraClipのターゲットとなる患者群を考えると、inoperableあるいはhigh-riskの患者、ないしは高齢者においては許容できる結果と考えられる。ただし、今後、MitraClipをよりlow riskの患者群に考慮する場合は、MitraClip単独では不十分で、特に弁輪拡大症例に関しては弁輪形成術も併用するべきと考える。我々の施設でも近々予定しているCardioband (https://www.valtechcardio.com/products/cardioband/)やMitralign (https://www.mitralign.com/themitralignsystem)などの経皮的僧帽弁弁輪形成術がどこまでfeasibleか、とても楽しみである。